Nghiên cứu hấp phụ Methylene xanh trong nước bằng vật liệu Nano Graphene
1. MỞ ĐẦU
Chất màu nói chung, các loại chất màu hữu cơ nói riêng được sử dụng khá rộng rãi trong hoạt động sống của con người. Đây cũng chính là nguồn gây ra tác động nguy hại cho sức khoẻ con người, cho môi trường sống. Hoạt động công nghiệp ngày càng phát triển như công nghệ dệt nhuộm, sản xuất giấy, giày da, nhựa… đã sử dụng một lượng lớn chất màu. Tải lượng chất màu trong dòng thải ngày càng lớn cộng với quản lý yếu kémdẫn đến ô nhiễm môi trường ngày càng gia tăng. Nhu cầu xử lý chất màu trong dòng thải là cấp thiết.
Hấp phụ là một trong nhữngphương pháp phổ biến, hiệu quả và dễ áp dụng để khử chất màu trong dòng nước thải. Các vật liệu hấp phụ phổ biến là than hoạt tính, zeolite, bentonite….
Nhiều nghiên cứu xử lý methylene xanh (MB) bằng phương pháp hấp phụ đã được thực hiện. Nghiên cứu hấp phụ MB trong nước bằng bentonite biến tính của Đoàn Thuý Ái đạt hiệu suất xử lý trên 95% ở pH=7, nồng độ chất màu 50 mg/l [1].
Y.S. Ngoh và cộng sự đã sử dụng hệ TiO2/bentonite để tách loại MB trong nước. Hiệu suấttách MB được nâng cao do TiO2 có thể giúp MB tham gia phản ứng quang hoá ngoài bị hấp phụ. Vật liệu có thể tái sử dụng đến 10 lần [2].
Shen-Tao Yang và cộng sự đã nghiên cứu sử dụng graphene oxit (GO) để hấp phụ MB trong nước. Dung lượng hấp phụ có thể đạt đến 714mg/l. Nồng độ ban đầu của MB trong nhỏ hơn 250 mg/l, hiệu suất tách đạt đến 99% [3]. Tuy nhiên, hạn chế của phương pháp là rất khó tách và thu hồi GO do GO phân tán rất tốt trong nước; khả tái sử dụng GO là rất thấp. Có thể khắc phục hạn chế này bằng cách sử dụngGO dạng khử (rGO).
Với tính chất đặc biệt như diện tích bề mặt riêng rất lớn (2.600 m2/g), bền nhiệt…, trong thời gian gần đây, graphene đã được nghiên cứu làm chất hấp phụ đối với: chất màu trong nước thải, kim loại nặng trong nước, hơi dung môi hữu cơ trong môi trường lao động. MB thường được sử dụng làm đối tượng màu trong hầu hết các nghiên cứu về xúc tác quang hoá trong hơn hai thập niên vừa qua.Đồng thời, MB cũng được sử dụng làm đối tượng màu trong tiêu chuẩn công nghiệp của Nhật Bản JIS R 1703-2:2007 về mô hình đánh giá khả năng tự làm sạch của bề mặt màng mỏng [4].
Trong bài báo này, graphene oxit dạng khử (rGO) được tổng hợp bằng phương pháp hoá học. MB được chọn làm đối tượng màu cho nghiên cứu. Khả năng hấp phụ MB của rGO được đánh giá, thảo luận.
2. NGHIÊN CỨU THỰC NGHIỆM
2.1. Hoá chất, thiết bị nghiên cứu
Graphite được mua từ hãng Sigma-aldrich với cỡ hạt < 45µm, dạng bột mịn. Các hoá chất khác được mua trên thị trường, dạng tinh khiết của Trung Quốc: H2SO4 98%, KMnO4, H2O2, NaNO3, HCl, ascobic acid 99%, methylene blue (MB). Các hoá chất được sử dụng ngay, không cần làm sạch hoặc tinh chế. rGO được tổng hợp từ graphite bằng phương pháp Hummers [5,6]. Khả năng hấp phụ MB được đánh giá bằng phương pháp quang phổ tử ngoại và khả kiến (UV-Vis, thực hiện trên máy Lambda 25 UV/VIS – Perkin Elmer, Mỹ).Các thiết bị khác: máy khuấy từ (IKA CMAG HS 4-CHLB Đức), cân điện tử (Ohaus SPS, 200±0.001g-Mỹ), máy đo pH(Hana HI 98107 – Ý), máy ly tâm (TDL- Trung Quốc) được sử dụng cho thí nghiệm.
2.2. Khảo sát ảnh hưởng của ph đến quá trình hấp phụ của vật liệu.
Chuẩn bị các dung dịch chất màu MB nồng độ 100 mg/l, pH dung dịch được điều chỉnh ở các mức 3, 5, 7, 9, 11. Sau đó, phân tán (bằng khuấy cơ học) lần lượt 0,02 g chất hấp phụ rGO vào 50 ml dung dịch MB đã chuẩn bị. Sau từng khoảng thời gian cố định lấy mẫu đem ly tâm lọc tách chất rắn, dung dịch thu được phân tích xác định nồng độ trên máy UV-Vis.
2.3. Khảo sát khả năng hấp phụ chất màu hữu cơ của vật liệu theo thời gian.
Phân tán lần luợt 0,02 g chất hấp phụ vào trong 50 ml dung dịch MB (pH=7, nồng độ 100 mg/l) bằng khuấy cơ học, nhiệt độ phòng. Sau từng khoảng thời gian cố định lấy mẫu đem ly tâm lọc tách chất rắn, dung dịch thu được phân tích trên máy UV-Vis.
2.4. Khảo sát ảnh hưởng của nồng độ chất màu hữu cơ đến khả năng hấp phụ của vật liệu.
Tiến hành phân tán lần luợt 0,02 g chất hấp phụ vào trong 50 ml dung dịch MB (pH=7)với các nồng độ khác nhau (từ 20 mg/l đến 100 mg/l).Dung dịch thu được phân tích trên máy quang phổ UV-Vis.
2.5. Tính toán hiệu suất hấp phụ
Hiệu suất hấp phụ (h %) được tính theo công thức:
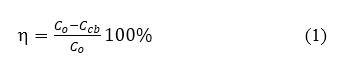
Trong đó: C0 là nồng độdung dịch Mb ban đầu(mg/l);Ccb: nồng độdung dịch MB lúc cân bằng (mg/l)
2.6 Một số mô hình đẳng nhiệt hấp phụ
2.6.1. Đẳng nhiệt hấp phụ Langmuir
Phương trình đẳng nhiệt hấp phụ Langmuir cho sự hấp phụ chất tan trong dung dịch trên chất hấp phụ rắn có dạng sau:
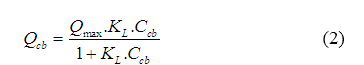
Trong đó:Qmax: lượng chất bị hấp phụ cực đại đơn lớp trên một đơn vị khối lượng chất hấp phụ (mg/g); KL: hằng số hấp phụ Langmuir (l/mg); Ccb: nồng độ cân bằng của dung dịch (mg/l); Qcb: dung lượng cân bằng hấp phụ của chất bị hấp phụ (mg/g);
Dạng phương trình (2) có thể viết lại như sau:
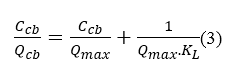
Các tham số Qcb và KLcó thể xác định bằng phương pháp hồi quy tuyến tính các số liệu thực nghiệm dựa vào đồ thị tương quan giữa Ccb/QcbvàCcb.
Dung lượng hấp phụ tại thời điểm t được xác định theo phương trình
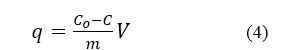
Trong đó: q là dung lượng hấp phụ tại thời điểm t(mg/g); C0:nồng độ dung dịch ban đầu(mg/l);C: nồng độ dung dịch MB tại thời điểm t(mg/l);V: thể tích dung dịch chất bị hấp phụ(l); m:khối lượng chất hấp phụ (g).
2.6.2. Đẳng nhiệt hấp phụ Freundlich
Mô hình Freundlich là một phương trình thực nghiệm áp dụng cho sự hấp phụ trên bề mặt không đồng nhất:
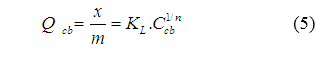
Trong đó x: khối lượng chất bị hấp phụ (mg); m: khối lượng chất hấp phụ (g); Ccb: nồng độ dung dịch lúc cân bằng (mg/l); Qcb: dung lượng cân bằng hấp phụ của chất bị hấp phụ; (mg/g); KF: hằng số Freundlich [(mg/g)(l/mg)1/n]; n: hệ số dị thể
Đường đẳng nhiệt hấp phụ Freundlich có thể được viết lại như sau:
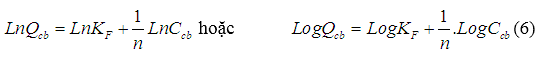
Giá trị KFvà n có thể được tính theo giản đồ sự phụ thuộc giữa LnQcbvà LnCcbhoặc LogQcbvà LogCcbbằng phương pháp hồi quy tuyến tính từ các số liệu thực nghiệm.
3. KẾT QUẢ VÀ THẢO LUẬN
3.1. Ảnh hưởng pH đến dung lượng hấp phụ MB của graphene
Kết quả khảo sát mối quan hệ pH và dung lượng hấp phụ MBđược thể hiện qua Bảng 1.
Bảng 1. Ảnh hưởng của pH đến hiệu suất hấp phụ màu MB của rGO
|
pH |
3 |
5 |
7 |
9 |
11 |
|
Hiệu suất hấp phụ (%) |
90,78 |
92,50 |
95,30 |
89,50 |
88,40 |
Từ kết quả cho thấy pH dung dịch đã có ảnh hưởng nhất định đến dung lượng hấp phụ MB của rGO. Tuy vậy, trong một khoảng pH rộng, hiệu suất thay đổi không quá lớn. Khi pH tăng, hiệu suất khử màu MB có xu hướng giảm. Tại pH=7 cho giá trị hiệu suất cao nhất. Điều này có thể do bề mặt của rGO bị khử lượng lớn các nhóm chức chứa oxy do vậy sự hấp phụ MB chủ yếu xảy ra do các liên kết mạnh của nhân thơm trong cấu trúc MBvới liên kết π-π của rGO. Giá trị pH=7 được chọn để tiếp tục nghiên cứu, đánh giá khả năng hấp phụ.
3.2. Ảnh hưởng của thời gian đến hiệu suất hấp phụ MB
Thực nghiệm tiến hành với nồng độ MB ban đầu là 100 mg/l, nhiệt độ phòng, pH dung dịch bằng 7. Hiệu suất khử MB được đánh giá sau các khoảng thời gian 10 phút, 30 phút, 60 phút, 120 phút và 180 phút. Kết quả thu được thể hiện ở Bảng 2
Bảng 2. Ảnh hưởng của thời gian đến dung lượng hấp phụ màu MB của rGO
|
Thời gian (phút) |
10 |
30 |
60 |
120 |
180 |
|
Dung lượng hấp phụ MB (mg/g) |
84,84 |
87,97 |
94,11 |
94,13 |
94,16 |
3.3 Mô hình hấp phụ đẳng nhiệt
Nghiên cứu đẳng nhiệt hấp phụ được thực hiện trong dung dịch có pH=7, nồng độ MB khác nhau. Nồng độ chất hấp phụ ở trạng thái cân bằng được tính toán trên các đường hấp phụ đẳng nhiệt ở các nồng độ MB ban đầu khác nhau. Phân tích hồi quy Ccb/Qcbvà Ccb(Ccb là nồng độ cân bằng, Qcb là dung lượng hấp phụ cân bằng) đối với mô hình Langmuir và hồi quy LnQcb và LnCcb đối với mô hình Freundlich. Kết quả được trình bày dưới đây.
3.3.1 Mô hình Langmuir
Kêt quả tính toán các giá trị nồng độ cân bằng trình bày ở Bảng 3.
Bảng 3. Sự phụ thuộc dung lượng hấp phụ vào nồng độ đối với MB
|
Co (mg/l) |
Ccb (mg/l) |
m (g) |
V (l) |
Qcb (mg/g) |
Ccb/Qcb |
|
20 |
3,77 |
0,02 |
0,05 |
40,57 |
0,09 |
|
40 |
9,69 |
0,02 |
0,05 |
75,77 |
0,13 |
|
60 |
17,27 |
0,02 |
0,05 |
106,82 |
0,16 |
|
80 |
25,74 |
0,02 |
0,05 |
135,65 |
0,19 |
|
100 |
37,90 |
0,02 |
0,05 |
155,25 |
0,24 |
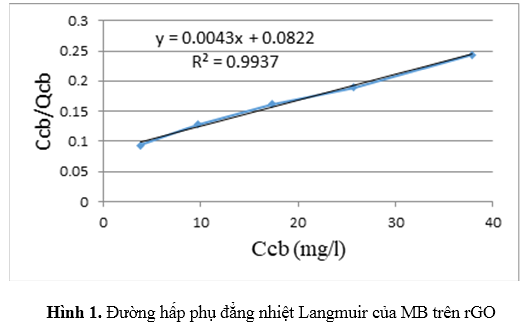
Từ kết quả ở Hình 1, ta tính được hệ số tương quan của hai đại lượng Ccb/Qcb và Ccb là R2= 0,9937 cho thấy mô hình hấp phụ đẳng nhiệt Langmuir mô tả tương đối chính xác sự hấp phụ MB trên vật liệu hấp phụ rGO. Từ phân tích hồi quy ta tính được các hệ số của phương trình Langmuir như sau:
Ccb/Qcb = 0,0043 Ccb + 0,0822
Từ phương trình trên ta tính được dung lượng hấp phụ cực đại Qmaxcủa vật liệu rGO là 232,56mg/g, hằng số của mô hình Langmuir là KL = 0,052 (l/mg)
Để xác định quá trình hấp phụ MB bằng rGO có phù hợp với dạng hấp phụ đơn lớp theo mô tả của mô hình Langmuir hay không, chúng tôi đánh giá mức độ phù hợp thông qua tham số cân bằng RL. Tham số RL được tính theo nồng độ đầu (Co) như sau:

Dựa vào tham số RLtheo Bảng 4 [6] để đánh giá mức độ phù hợp của mô hình hấp phụ Langmuir đối với rGO.
Bảng 4. Phân loại sự phù hợp của mô hình đẳng nhiệt bằng tham số RL
|
Giá trị RL |
Dạng mô hình đẳng nhiệt |
|
RL>1 |
Không phù hợp |
|
RL= 1 |
Tuyến tính |
|
0 < RL< 1 |
Phù hợp |
|
RL= 0 |
Không thuận nghịch |
Bảng 5. Giá trị tham số cân bằng RL của quá trình hấp phụ MB bằng rGO
|
Co(mg/l) |
20 |
40 |
60 |
80 |
100 |
|
RL |
0,490 |
0,325 |
0,243 |
0,194 |
0,161 |
Từ giá trị tham số RLtính toán được, cho thấy giá trị này trong khoảng từ 0,161 – 0,49, đều nhỏ hơn 1, nên có thể xác định được mô hình hấp phụ đẳng nhiệt Langmuir là phù hợp với quá trình hấp phụ MB bằng rGO.
3.3.2. Mô hình Freundlich
Bảng 6. Sự phụ thuộc LnQcb vào LnCcb đối với mô hình Freundlich của MB
|
Co (mg/l) |
rGO |
|
|
LnQcb |
LnCcb |
|
|
100 |
3,703 |
1,327 |
|
200 |
4,328 |
2,271 |
|
300 |
4,671 |
2,849 |
|
400 |
4,910 |
3,248 |
|
500 |
5,045 |
3,635 |
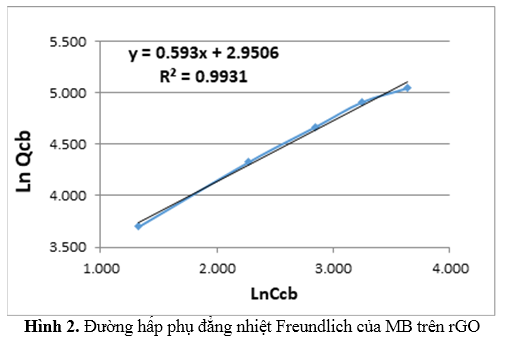
Bảng 6 và đồ thị Hình 2 mô tả quá trình hấp phụ MB trên vật liệu hấp phụ theo mô hình đẳng nhiệt Freundlich. Các hệ số của phương trình Freundlich thu được từ quá trình hồi quy LnQcbtheo LnCcbnhưsau:LnQcb = 0,593LnCcb + 2,9506
Từ phương trình trên ta tính được hằng số hấp phụ Freundlich KF= 19,12 [(mg/g)(l/mg)1/N] và giá trị hằng số 1/n = 0,5929. Hệ số tương quan của LnQcb và LnCcb là R2 = 0,9931. So sánh kết quả từ hai mô hình ta thu được bảng sau:
Bảng 7. Các thông số đẳng nhiệt hấp phụ Langmuir và Freundlich của rGO đốivới MB
|
Mô hình hấp phụ đẳng nhiệt |
Giá trị |
|
Langmuir: |
|
|
Qmax(mg/g) |
232,56 |
|
KL(L/mg) |
0,052 |
|
R2 |
0,9937 |
|
RL |
0,161 |
|
Freundlich: |
|
|
1/n |
0,5929 |
|
KF[(mg/g)(L/mg)1/n] |
19,12 |
|
R2 |
0,9931 |
4. KẾT LUẬN
rGO được tổng hợp từ graphite bằng phương pháp Hummers, có khả năng hấp phụ methylene xanh (MB) trong nước với dung lượng hấp phụ cực đại là 232,56 mg/g. Quá trình khảo sát cho thấy rGO có thể hấp phụ MB tốt ở điều kiện pH=7. Đây là điều kiện dễ thực hiện trong thực tế. Quá trình hấp phụ có thể được biểu diễn theo mô hình Freudlich và Langmuir, nhưng phù hợp hơn với mô hình Langmuir.
TÀI LIỆU THAM KHẢO
[1]. Đ. T.T. Ái (2013), Khảo sát khả năng hấp phụ chất màu xanh methylen trong môi trường nước của vật liệu CoFe2O4/bentonite, Tạp chí Khoa học và phát triển, Vol. 11, no. 2, pp. 236–238, 2013. [2]. Nawi, Y. S. N. M. A. (2016). Role of bentonite adsorbent sub-layer in the photocatalytic- adsorptive removal of methylene blue by the immobilized TiO2 / bentonite system. International Journal of Environmental Science and Technology, 13(3), 907–926. https://doi.org/10.1007/s13762-015-0928-5. [3]. Yang, S. T., Chen, S., Chang, Y., Cao, A., Liu, Y., & Wang, H. (2011). Removal of methylene blue from aqueous solution by graphene oxide. Journal of Colloid and Interface Science, 359(1), 24–29. https://doi.org/10.1016/j.jcis.2011.02.064. [4]. Murugan, K., Rao, T. N., Gandhi, A. S., & Murty, B. S. (2010). Effect of aggregation of methylene blue dye on TiO2 surface in self-cleaning studies. Catalysis Communications, 11(6), 518–521. https://doi.org/10.1016/j.catcom.2009.12.007. [5]. Hà Quang Ánh (2016), Nghiên cứu tổng hợp và đặc trưng vật liệu mới cấu trúc nano trên cơ sở graphene ứng dụng trong xử lý môi trường, Luận án Tiến sỹ, Viện Hàn lâm Khoa học và CN Việt Nam. [6]. Xiaoming Peng, Dengpo Huang, Tareque Odoom-Wubah, Dafang Fu, Jiale Huang, Qingdong Qin, (2014), “Adsorption of anionic and cationic dyes on ferromagnetic ordered mesoporous carbon from aqueous solution: Equilibrium, thermodynamic and kinetics”, Journal of Colloid and Interface Science, 430,272–282.Lê Minh Đức1, Trương Ngọc Sang2, Nguyễn Thị Hường2
1Phân viện Khoa học An toàn Vệ sinh lao động và Bảo vệ môi trường miền Trung
2Khoa Hoá, Trường ĐH Sư phạm, ĐH Đà Nẵng
(Nguồn tin: Vnniosh.vn)
