Nghiên cứu thí nghiệm đánh giá hiệu quả xử lý thuốc bảo vệ thực vật Glyphosat bằng một số công nghệ oxy hóa nâng cao
MỞ ĐẦU
Việc sử dụng thuốc bảo vệ thực vật trong sản xuất nông nghiệp là nguyên nhân dẫn đến ô nhiễm nguồn nước mặt ở nông thôn. Các phương pháp phổ biến hiện nay để xử lý nước bị ô nhiễm bởi thuốc bảo vệ thực vật là hấp phụ, oxi hóa hóa học, phương pháp màng lọc, phương pháp sinh học. Trong đó phương pháp hấp phụ và lọc màng là không triệt để bởi vì chất ô nhiễm chỉ được thu giữ trong chất hấp phụ và màng lọc, cần phải được xử lý tiếp. Phương pháp sinh học và oxy hóa hóa học hiệu quả không cao do hầu hết các chất BVTV bền, khó bị phân hủy hóa học và sinh học. Một số nghiên cứu gần đây cho thấy phương pháp oxy hóa nâng cao (AOP- Advanced oxidation process) dường như là giải pháp hứa hẹn để xử lý đối tượng ô nhiễm dạng này. Trong nhóm các phương pháp oxi hóa nâng cao, phụ thuộc vào cách thức tạo ra gốc tự do ●OH mà chia thành các phương pháp khác nhau [1]. Bài báo này sẽ nghiên cứu thí nghiệm đánh giá, so sánh khả năng xử lý thuốc diệt cỏ glyphosate trong nước – một loại thuốc diệt cỏ hậu nảy mầm, không chọn lọc, được sử dụng rất phổ biến ở nước ta hiện nay – bằng các quá trình oxi hóa nâng cao như fenton điện hóa và oxi hóa điện hóa, từ đó đề xuất giải pháp sẽ áp dụng trong thực tiễn để xử lý hiệu quả các hóa chất BVTV nói chung trong các nguồn nước.
I. TỔNG QUAN
Oxy hóa nâng cao AOP là quá trình sử dụng gốc hydroxyl OH● có tính oxy hóa cực mạnh (Thế oxy hóa khử E° = 2,7 V/ESH) để oxy hóa các chất ô nhiễm ở nhiệt độ và áp suất môi trường. Tuy thời gian tồn tại của các gốc OH● là rất ngắn, cỡ 10-9 giây nhưng các gốc OH● có thể oxy hóa các chất hữu cơ với hằng số tốc độ phản ứng rất lớn, từ 106 đến 109 L.mol-1.s-1[2].
Quá trình oxy hóa các hợp chất hữu cơ (RH hay PhX), cơ kim loại và chất vô cơ có thể được thực hiện bởi 3 cơ chế sau [3]:
- Tách 1 nguyên tử hydro (đề hydro hóa):
OH● + RH → R● + H2O (1)
- Phản ứng cộng ở liên kết chưa no (hydroxylation):,
OH● + PhX → HOPhX● (2)
- Trao đổi electron (oxy hóa – khử):
OH● + RH → RH+● + OH− (3)
OH● + RX → RXOH● → ROH+● + X− (4)
Trong số các phản ứng này, phản ứng cộng vào ở vòng thơm (cấu trúc phổ biến của các chất ô nhiễm hữu cơ bền) có hằng số tốc độ từ 108 đến 1010 L mol-1.s-1 [4]. Do đó, hiện nay các quá trình AOP được xem như là nhóm các phương pháp xử lý rất hiệu quả các chất ô nhiễm hữu cơ bền (POPs – Persistant Organic Pollutants) khó hoặc không bị phân hủy sinh học trong nước thành CO2, H2O và các chất hữu cơ ngắn mạch hơn, ít độc hơn và có thể bị phân hủy sinh học.
Theo cách thức tạo ra gốc OH●, AOP được chia thành các phương pháp khác nhau như trên hình 1. Theo cơ quan bảo vệ môi trường Mỹ (USEPA), dựa theo đặc tính của quá trình có hay không sử dụng nguồn năng lượng bức xạ tử ngoại UV mà có thể phân loại các quá trình oxi hoá nâng cao thành 2 nhóm:
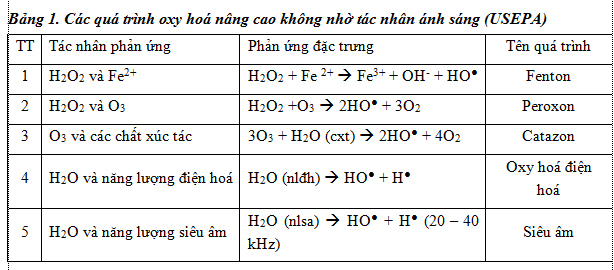
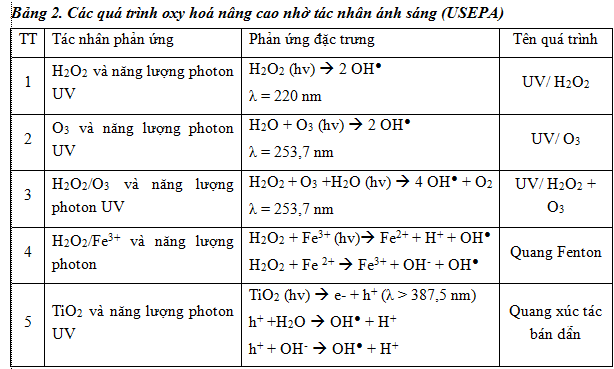
– Các quá trình oxy hoá nâng cao không nhờ tác nhân ánh sáng: là các quá trình tạo ra gốc OH● mà không nhờ năng lượng bức xạ tia cực tím trong quá trình phản ứng (bảng 1).
– Các quá trình oxy hoá nâng cao nhờ tác nhân ánh sáng : là các quá trình tạo ra gốc OH● nhờ năng lượng tia cực tím UV (Bảng 2).

Nhóm nghiên cứu lựa chọn 2 công nghệ để nghiên cứu thí nghiệm khả năng xử lý của chúng đối với thuốc bảo vệ thực vật là phương pháp Fenton điện hoá và phương pháp oxi hoá điện hoá.
Phương pháp Fenton điện hóa
Về bản chất, quá trình fenton điện hóa là quá trình oxy hóa nâng cao, dựa trên phản ứng fenton (1) giữa Fe2+ và H2O2 để tạo ra gốc tự do ●OH. Gốc tự do ●OH sau đó sẽ tác dụng với các chất ô nhiễm, phân hủy chúng thành các sản phẩm cuối cùng là CO2, H2O, các axit vô cơ đơn giản. Tuy nhiên, khác với fenton hóa học, H2O2 không phải đưa vào từ đầu mà được sinh ra liên tục bằng sự khử 2 electron của phân tử oxy trên điện cực catot theo phương trình phản ứng (PTPƯ) (2). Ion Fe3+ được sinh ra từ phản ứng (5) ngay lập tức bị khử trên catot để tái sinh lại Fe2+ theo PTPƯ (3).
Fe2+ + 2H2O2 → Fe3+ + OH– + OH● (1)
O2 + 2H+ + 2e– → H2O2 E° = 0,69 V/ ESH (2)
Fe3+ + e– → Fe2+ E° = 0,77 V/ ESH (3)
Như vậy, trong quá trình Fenton điện hóa, ion Fe2+ và Fe3+ liên tục chuyển hóa cho nhau, do đó xúc tác đưa vào ban đầu có thể là Fe2+ hoặc Fe3+, và chỉ cần một nồng độ nhỏ, dưới 1 mM, là có thể thực hiện hiệu quả phản ứng Fenton.
Phương pháp oxi hóa điện hóa
Oxy hóa điện hóa (EOP – electrochemical oxidation process): là quá trình oxy hóa nâng cao trong đó gốc OH● được sinh ra bằng các quá trình điện hóa xảy ra trên các điện cực. Quá trình EOP có thể dễ dàng tự động hóa và hiệu suất quá trình phá hủy tăng đáng kể nhờ số lượng gốc OH● tăng mạnh khi sử dụng các điện cực có diện tích bề mặt lớn.
Về cơ chế phản ứng, quá trình phản ứng trải qua 2 giai đoạn [5]. Giai đoạn đầu, phân tử nước bị oxi hóa trên anot tạo thành gốc tự do OH● bị giữ lại ở các vị trí hoạt động của điện cực “M” theo PTPƯ (4)
H2O + M à M[HO●] + H+ + e– (4)
R + M[HO●] à M + RO + H+ +e– (5)
R + M[HO●] à M + mCO2 + nH2O + H+ +e– (6)
Sau đó, diễn ra quá trình oxi hóa các phân tử hợp chất hữu cơ “R” bởi các gốc tự do ở các vị trí hoạt động trên điện cực theo PTPƯ (5) và có thể bị oxi háo hoàn toàn thành CO2 theo PTPƯ (6). Ở đây, RO thể hiện phân tử hữu cơ đã bị oxi hóa một phần. RO hoàn toàn có thể bị oxy hóa ở những nấc sâu hơn bởi các gốc tự do OH● luôn được sinh ra trong quá trình oxi hóa anot [6].
II. NGHIÊN CỨU THÍ NGIỆM
2.1. Sơ đồ thí nghiệm
Phương pháp Fenton điện hoá
Hệ thí nghiệm fenton điện hóa được minh họa trên hình 2. Điện cực catot (2) được sử dụng là vải Cacbon diện tích 60 cm2, anot (3) là tấm lưới Pt diện tích 45 cm2, tất cả hệ được đặt trong cốc thủy tinh (1) dung tích 250 mL. Dung dịch được khuấy đều bởi khuấy từ (4). Khí nén được sục liên tục vào dung dịch để cấp oxy cho quá trình tạo H2O2 (theo PTPƯ (2)). Nguồn 1 chiều VSP4030 (B&K Precision, CA, US) cung cấp dòng điện 1 chiều cho quá trình điện phân.
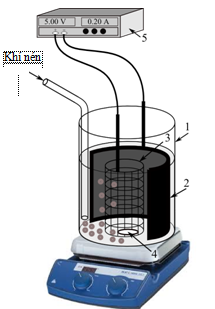
Hình 2. Sơ đồ hệ thống thí nghiệm fenton điện hóa
(1): Cốc thủy tinh, (2): Catot, (3): Anot, (4): Con khuấy từ, (5): Nguồn 1 chiều.
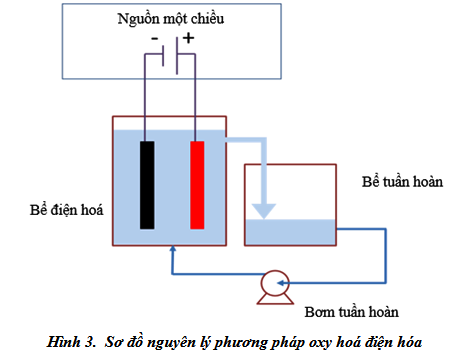
Phương pháp oxy hoá điện hoá
Thí nghiệm được thiết kế như Hình 3. Quá trình oxy hoá điện hoá xử lý dung dịch glyphosate được tiến hành theo mẻ trong bể điện hoá bằng thuỷ tinh hữu cơ với kích thước 20 mm (rộng) x 150 mm(dài) x 180 mm (cao). Bộ điện cực bao gồm 1 điện cực âm và một điện cực dương được đặt cách nhau 10 mm. Điện cực được đặt trong bể điện hoá bằng thuỷ tinh hữu cơ và cách đáy bể 20 mm. Điện cực dương được làm bằng Titan phủ chì oxit. Điện cực âm hình chữ nhật được làm bằng Titan. Kích thước của điện cực được thiết kế với kích thước 100 x 110 mm. Nguồn điện được sử dụng là nguồn điện một chiều sử dụng nguồn DC generator VSP4030 (B&K Precision, CA, US). Bể tuần hoàn được làm bằng vật liệu giống với bể điện hoá. Trong tất cả các thí nghiệm tổng lượng nước thải sử dụng cho mỗi thí nghiệm là 1 lít. Thể tích của bể điện hoá là 540 ml và thể tích của bể tuần hoàn là 460 ml.
2.2. Hóa chất, thiết bị phân tích
Hóa chất: Vải carbon dùng làm catot của hãng Johnson Matthey, Đức. Các hóa chất sử dụng trong nghiên cứu có độ tinh khiết cao: Glyphosate 96% (C3H8NO3P) của Sigma Aldrich NY, USA; FeSO4.7H2O (99,5%, Merck) được sử dụng làm chất xúc tác; Na2SO4 (99%, Merck) được thêm vào dung dịch phản ứng để tăng độ dẫn điện cho dung dịch, H2SO4 (98%, Merck) được sử dụng để điều chỉnh pH ban đầu của dung dịch phản ứng về môi trường axit tạo điều kiện cho phản ứng Fenton xảy ra.
Ninhydrin (C9H6O4, Merck); Natri Molybdat (Na2MoO4, Merck) sử dụng trong các phân tích định lượng glyphosate bằng phương pháp đo quang.
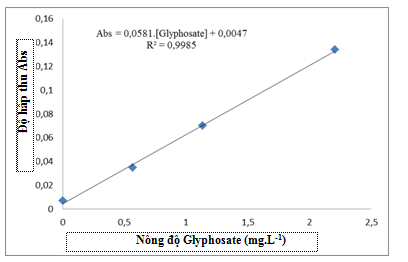
Hình 4. Đường chuẩn xác định nồng độ Glyphosate bằng phương pháp trắc quang.
Thiết bị phân tích: Việc phân tích hàm lượng Glyphosate được tiến hành bằng phương pháp phân tích trắc quang, sử dụng thiết bị quang phổ khả kiến Genesys 10S VIS (Mỹ) đo tại bước sóng 570 nm. Nguyên tắc xác định hàm lượng Glyphosate của thiết bị là dựa vào phản ứng của Glyphosate với Ninhydrin, xúc tác là Na2MoO4 (phản ứng diễn ra tại nhiệt độ 100oC trong thời gian 10 phút) và sản phẩm của phản ứng có giá trị quang phổ hấp thụ cực đại tại bước sóng 570 nm. Đường chuẩn của phương pháp được xây dựng như trên Hình 4.
2.3. Chuẩn bị dung dịch mẫu
Dung dịch mẫu được sử dụng trong suốt quá trình nghiên cứu được chuẩn bị trong phòng thí nghiệm bằng cách pha loãng glyphosate (C3H8NO3P; CAS #1071-83-6) vào nước siêu lọc. Glyphosate sử dụng trong nghiên cứu có độ tinh khiết ≥ 96%. Dung dịch chuẩn glyphosate được chuẩn bị bằng cách hoà tan 1,69 g glyphosate vào 1 lít nước tinh khiết. Dung dịch được khuấy đều với tốc độ 250 vòng/ph trong vòng 20 phút. Dung dịch mẫu được chuẩn bị bằng cách đưa một lượng dung dịch chuẩn vào bình tam giác và trộn đều với nước tinh khiết để đạt được nồng độ cuối là 0,025 – 0,2 mmol/l trong đó thì Na2SO4 0,01 mol/l được thêm vào nhằm tăng độ dẫn của dung dịch mẫu.
III. KẾT QUẢ NGHIÊN CỨU
Để đánh giá, so sánh khả năng phân hủy Glyphosate bằng quá trình fenton điện hóa và oxy hóa điện hóa, các thí nghiệm được bố trí như trong bảng sau:
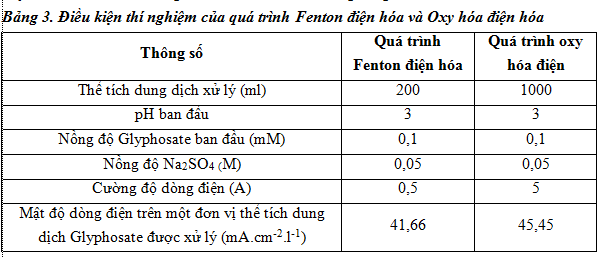
Cả 2 quá trình nghiên cứu đều là quá trình điện hóa, do đó đại lượng mật độ dòng điện tính trên một đơn vị thể tích dung dịch xử lý là quan trọng nhất, thể hiện mức độ tiêu thụ điện năng cho 1 đơn vị thể tích được xử lý. Từ bảng 3 trên có thể thấy mật độ dòng điện trên một đơn vị thể tích được xử lý của 2 quá trình là gần tương đương nhau. Đây là cơ sở để có thể so sánh hiệu quả xử lý của 2 quá trình.
Đối với mỗi thí nghiệm, hàm lượng Glyphosate còn lại trong dung dịch ở các thời điểm khác nhau từ 0 đến 60 phút được phân tích bằng phương pháp trắc quang. Các kết quả thu được thể hiện trên đồ thị hình 5. Có thể thấy rằng đối với cả 2 quá trình, trong khoảng 5 phút đầu tiên, nồng độ Glyphosate giảm rất nhanh, sau đó tốc độ giảm chậm dần. Thật vậy, theo định luật Faraday, lượng chất bị điện phân trên các điện cực tỉ lệ thuận với thời gian điện phân, do đó trong quá trình Fenton điện hóa, lượng H2O2 sinh ra trên catot (PTPƯ (2)) tăng dần theo thời gian, dẫn đến lượng gốc tự do ●OH sinh ra (theo PTPƯ (1)) cũng tăng dần theo thời gian; tương tự với quá trình oxy hóa điện hóa, lượng gốc tự do ●OH sinh ra theo PTPƯ (4) cũng tăng dần theo thời gian điện phân. Kết quả là lượng Glyphosate bị oxy hóa bởi ●OH tăng dần, hay nói cách khác nồng độ Glyphosate còn lại trong dung dịch giảm dần theo thời gian. Mặt khác, trong khoảng 5 phút đầu, nồng độ Glyphosate trong dung dịch phản ứng lớn, nên theo định luật tác dụng khối lượng, tốc độ phản ứng rất nhanh, lượng Glyphosate giảm nhanh, sau đó do lượng Glyphosate còn lại ít nên tốc độ phản ứng sẽ chậm lại, lượng Glyphosate giảm chậm.
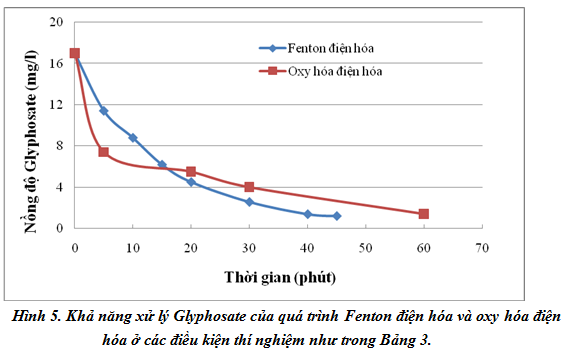
Mặt khác, cũng từ đồ thị hình 5 có thể thấy rằng Có thể thấy rằng cả 2 quá trình fenton điện hóa và oxy hóa điện hóa đều có thể xử lý được Glyphosate tương đối hiệu quả, cụ thể là nồng độ glyphosate còn lại trong dung dịch giảm dần theo thời gian và sau 45 phút, khoảng 92,96% Glyphosate đã bị phân hủy bởi quá trình fenton điện hóa và sau 60 phút, khoảng 91,76% Glyphosate đã bị xử lý bởi quá trình oxy hóa điện hóa.
Tuy nhiên, trong mỗi quá trình xử lý, sự phân hủy Glyphosate là không giống nhau. Từ hình 5 có thể thấy rằng trong khoảng 5 phút đầu tiên, quá trình oxy hóa điện hóa xử lý rất tốt Glyphosate, đường biểu diễn nồng độ có độ dốc lớn, sau đó, quá trình phân hủy Gltphosate bắt đầu giảm dần, tốc độ phân hủy dần đi vào ổn định. Trong khi đó, trong khoảng 5 phút đầu tiên, tốc độ phân hủy Glyphosate của quá trình fenton điện hóa chậm hơn nhiều so với quá trình oxy hóa điện hóa, nhưng sau đó quá trình phân hủy Glyphosate bởi Fenton điện hóa lớn hơn oxy hóa điện hóa, dẫn đến chỉ sau 45 phút phản ứng, 92,96% Glyphosate đã bị phân hủy trong khi với quá trình oxy hóa điện hóa, phải mất 60 phút thì 91,76% Glyphosate mới bị phân hủy. Nguyên nhân của sự khác biệt này có thể là do trong quá trình oxy hóa điện hóa, gốc tự do ●OH được sinh ra trực tiếp từ quá trình điện phân H2O trên anot, trong khi đó, với quá trình fenton điện hóa, để sinh ra gốc tự do ●OH, đầu tiên H2O2 phải được sinh ra bới quá trình khử trên catot theo PTPƯ (2), sau đó H2O2 mới phản ứng với xúc tác Fe2+ để tạo thành gốc tự do H2O2 theo PTPƯ (1), do đó trong giai đoạn đầu của quá trình xử lý, tốc độ phân hủy Glyphosate bởi Fenton điện hóa thấp hơn bởi Oxy hóa điện hóa. Sau 5 phút, lượng H2O2 được sinh ra đủ và ổn định, ion Fe3+ được sinh ra từ phản ứng (1) cũng liên tục bị khử thành chất xúc tác Fe2+ do đó tốc độ sinh ra gốc tự do ●OH bởi quá trình Feton điện hóa (PTPƯ (1)) là ổn định, dẫn đến lượng Glyphosate bị phân hủy với tốc độ ít thay đổi, trong khi đó với quá trình oxi hóa điện hóa, trong 5 phút đầu tiên, lượng gốc tự do ●OH được sinh ra đã chiếm phần lớn các vị trí hoạt động trên bề mặt điện cực (PTP Ư(4)), do đó sau thời điểm này tốc độ tạo thành M[HO●] sẽ giảm, dẫn đến tốc độ phân hủy Glyphosate bởi quá trình oxy hóa điện hóa sẽ giảm dần như trên đồ thị hình 5.
Như vậy có thể thấy rằng quá trình Fenton điện hóa xử lý Glyphosate nhanh hơn quá trình oxy hóa điện hóa. Tuy nhiên, trong quá trình thí nghiệm, chúng tôi nhận thấy rằng, nếu liên tục sử dụng dòng điện có cường độ lớn trên 0,6A thì sau khoảng 100 giờ làm việc, điện cực vải cacbon sẽ bị hỏng (hình 6). Đây chính là nhược điểm của công nghệ fenton điện hóa. Trong khi đó, với quá trình oxi hóa điện hóa, các điện cực đều rất bền cơ học không có hiện tượng bị hỏng hay biến dạng điện cực nên có thể sử dụng trong một thời gian rất dài.

KẾT LUẬN
Nghiên cứu này đã chỉ ra rằng cả 2 phương pháp fenton điện hóa và oxi hóa điện hóa đều có thể xử lý hiệu quả thuốc diệt cỏ Glyphosate trong nước, cụ thể sau 45 phút xử lý, 92,96% Glyphosate bị phân hủy bởi quá trình fenton điện hóa, trong khi với quá trình oxy hóa điện hóa, 91,76% Glyphosate bị phân hủy. Trong 5 phút đầu tiên, tốc độ phân hủy của quá trình oxy hóa điện hóa nhanh hơn fenton điện hóa, nhưng sau đó, tốc độ phân hủy của quá trình fenton điện hóa lại nhanh hơn oxy hóa điện hóa. Về mặt hiệu suất xử lý, quá trình fenton điện hóa có hiệu suất cao hơn quá trình oxy hóa điện hóa, tuy nhiên, điện cực vải cacbon sử dụng trong quá trình fenton điện hóa lại nhanh bị hỏng hơn các điện cực sử dụng trong quá trình oxy hóa điện hóa. Kết quả này mở ra một triển vọng có thể áp dụng các quá trình oxy hóa nâng cao như fenton điện hóa hoặc oxi hóa điện hóa trong thực tế để xử lý các hóa chất BVTV trong các nguồn nước.
LỜI CÁM ƠN
Công trình này được ủng hộ bởi đề tài thuộc 7 hướng ưu tiên cấp Viện Hàn lâm Khoa học và Công nghệ Việt Nam ‘Nghiên cứu xử lý nước ô nhiễm hóa chất bảo vệ thực vật bằng quá trình oxy hóa điện hóa kết hợp với thiết bị phản ứng sinh học- màng MBR’ (VAST 07.03/15-16).
TÀI LIỆU THAM KHẢO
- Lê Thanh Sơn, Trần Mạnh Hải, Đoàn Tuấn Linh, Lưu Tuấn Dương (2017). Khả năng ứng dụng phương pháp oxy hóa nâng cao trong xử lý thuốc bảo vệ thực vật. Trường hợp fenton điện hóa. Tạp chí Hoạt động Khoa học Công nghệ, số 1,2&3, 56-63.
- J. Hoigné (1997), Inter-calibration of OH radical sources and water quality parameters, Water Science and Technology 35, 1-8.
- G. V. Buxton;, C. L. Greenstock;, and W. P. H. a. A. B. Ross (1988), Critical Review of rate constants for reactions of hydrated electrons Chemical Kinetic Data Base for Combustion Chemistry. Part 3: Propane, The Journal of Physical Chemistry 17, 513-886.
- M. A. Oturan (2000), An ecologically effective water treatment technique using electrochemically generated hydroxyl radicals for in situ destruction of organic pollutants: Application to herbicide 2,4-D, Journal of Applied Electrochemistry 30, 475-482.
- Comninellis C; Pulgarin C (1993), Electrochemical oxidation of phenol for wastewater treatment using SnO2, J. Appl. Electrochem, 23, 108-12.
- Gandini D, Comninellis C, Tahar NB, Savall A (1998), Electrodépollution: traitement électrochimique des eaux résiduaires chargées en matières organiques toxiques, Actualité Chimique, 10, 68 – 73.
TS. Lê Thanh Sơn, Đoàn Tuấn Linh
Viện Công nghệ Môi trường, Viện Hàn Lâm Khoa học và Công nghệ Việt Nam.
(Nguồn tin: Vnniosh.vn)
