Nghiên cứu xây dựng quy trình quan trắc tổng vi khuẩn hiếu khí và tổng nấm trong không khí môi trường lao động
ĐẶT VẤN ĐỀ
Vi sinh vật trong không khí gồm rất nhiều chủng loại khác nhau như cầu khuẩn gây bệnh, phảy khuẩn, trực khuẩn lao, trực khuẩn bạch hầu, nấm mốc gây bệnh và sinh độc tố và các tạp khuẩn khác, có nguy cơ gây hại cho người và động vật, ảnh hưởng đến môi trường sống.Quan trắc vi sinh vật trong không khí là một cách để dự phòng và định hướng những nguy cơ tiểm ẩn gây ra bởi ô nhiễm sinh học trong không khí [3; 4; 5].Trong khuôn khổ bài báo này trình bày kết quả nghiên cứu của nhiệm vụ “Xây dựng quy trình phân tích tổng nấm và vi khuẩn hiếu trong không khí môi trường lao động, mã số NVMT/2013/01/TLĐ, do Viện nghiên cứu KHKT bảo hộ lao động chủ trì.
I. ĐỐI TƯỢNG, PHƯƠNG PHÁP VÀ THIẾT BỊ NGHIÊN CỨU
1.1. Đối tượng nghiên cứu
Đối tượng nghiên cứu là tổng vi khuẩn hiếu khí và tổng nấm trong không khí môi trường lao động.
1.2. Phương pháp nghiên cứu
1.2.1. Phương pháp xây dựng quy trình phân tích
Khảo sát để chứng minh tính chính xác của phương pháp thông qua các thông số như: độ lặp lại, độ tái lặp, độ ổn định, giới hạn phát hiện, giới hạn định lượng và độ không đảm bảo đo.
1.2.2. Phương pháp lấy mẫu
Sử dụng thiết bị Spin Air lấy mẫu vi sinh vật trong không khí, nguyên lý của thiết bị dùng lực hút chân không hút không khí va đập vào bề mặt của đĩa thạch. Tốc độ lấy mẫu 100 lít/phút, đường kính đĩa thạch 90 và 100 cm.
Phương pháp so sánh là phương pháp đặt đĩa thạch (theo nguyên lý Korch).Mật độ các vị trí lấy mẫu 5 vị trítrong không gian 10 -20 m2.
Khu vực cần quan trắc rộng thì được chia dạng mắt lưới lấy mẫu theo mật độ các ô nhỏ (theo thường quy Bộ Y tế 2002).
1.2.3. Các công thức tính toán. [5]
+ Công thức xác định tổng vi sinh vật trong 1 m3 không khí của phương pháp chủ động.
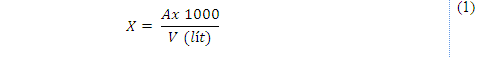
Trong đó:
X: Tổng số vi sinh vật trong 1m3 không khí (CFU/m3)
A: Tổng số vi sinh vật đếm được trong đĩa thạch
1.000: 1 m3 không khí được quy đổi tương đương với 1.000 lít không khí
V: thể tích lấy mẫu
+ Công thức tính độ lệch chuẩn (Sr):
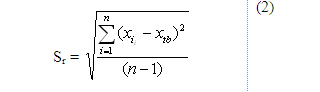
Trong đó:
xi: Nồng độ chất phân tích ở thí nghiệm thứ i
xtb: Nồng độ nồng độ trung bình của mẫu với n lần lặp lại
n: Số lần lặp lại
+ Công thức tính độ tái lặp SR
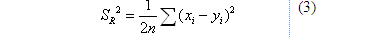
Trong đó:
xi: Nồng độ chất phân tích ở thí nghiệm thứ i trong điều kiện TN 1
yi: Nồng độ chất phân tích ở thí nghiệm thứ i trong điều kiện TN 2
n: Số lần lặp lại
+ Độ lệch chuẩn tương đối hay hệ số biến thiên (RSD, %)
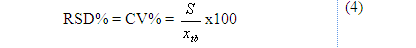
Trong đó:
S: Độ lệch chuẩn
+ Công thức tính độ không đảm bảo đo

Trong đó:
U : Độ không đảm bảo đo (%)
CV% : Hệ số biến thiên của kết quả đo (%),
tα,k : Giá trị t tra bảng với mức ý nghĩa α = 0,05; bậc tự do k = n – 1
n : Số lần phân tích lặp lại
1.3. Thiết bị sử dụng và môi trường nuôi cấy
1.3.1. Thiết bị
Thiết bị lấy mẫu vi sinh trong không khí: Spin Air (IUL), bao gồm 2 loại vận tốc hút khí là 100 lít/phút và 60 lít/phút và có 4 chế độ quay vòng chậm trong quá trình lấy mẫu, số lượng lỗ trên nắp lấy mẫu là 400, kích thước lỗ là 0,7 mm.
Thiết bị trong phòng thí nghiệm bao gồm: Tủ ấm, Đức. Máy khuấy từ IKA, Ý. Kính hiển vi soi nổi Bel, Ý. Kính hiển vi sinh học Nikon E100, Nhật Bản. Tủ cấy vi sinh, hệ thống phòng sạch và an toàn sinh học tại Viện Nghiên cứu KHKT Bảo hộ lao động. Máy đếm khuẩn lạc SC 06 Bibby, Anh.
1.3.2. Môi trường nuôi cấy
Môi trường MacConkey cơ bản (g/l): Pepton 20; lactoza 10; muối mật 1,5; NaCl 5; thạch 20; nước cất 1.000 ml; pH 6,8 ÷ 7,0, khử trùng 121 oC, 15 phút.
Môi trường thạch máu (g/l): Thạch 15; pepton 5; meat extract 3; máu thỏ100 ml; nước cất 1.000 ml; điều chỉnh pH 7,4÷7,6, khử trùng121oC,15 phút. Để nguội 45÷ 50 oC, cho 50ml máu vào quay tròn bình cho máu hòa tan đều trong thạch. Màu thạch đỏ tươi là đạt tiêu chuẩn. Nếu môi trường màu ngả đen là máu đã chín. Để nguội 45÷50 oC đổ 20ml/đĩa.
Môi trường Sabouraud (g/l): Pepton 10; glucoza 20; thạch 20; nước cất 1.000 ml; pH 5,4 ÷ 5,8 khử trùng 121 oC, 15 phút.
Môi trường MEA (g/l): Pepton 10; glucoza 20; thạch 20; nước cất 1.000 ml; pH 5,0 ÷ 5,5;khử trùng 121oC, 15 phút.
Môi trường TSA (g/l): Pepton 10; Soybean 20; thạch 20; nước cất1.000 ml; pH 6,8 ÷ 7,2khử trùng 121oC, 15 phút.
Môi trường Czapek (g/l): NaNO3; 3,5; K2HPO4; 1,5; MgSO4 0,5; KCl 0,5; FeSO4 0,1; glucoza 80 g; thạch 20;pH 4,5 ÷ 5,5 khử trùng 121oC, 15 phút.
II. KẾT QUẢ VÀ THẢO LUẬN
2.1. Kết quả nghiên cứu chọn môi trường nuôi cấy
Nghiên cứu sử dụng ba chủng chuẩn của bảo tàng giống chuẩn Mỹ (ATCC) là E. coli ATCC® 25922TM, E. aerogenes ATCC® 13048TM, S. aureus ATCC®25923TM, cấy lên đĩa thạch MacConkey, TSA, NA và thạch máu nuôi cấy ở điều kiện môi trường là 37 ± 0,5 oC. Kết quả cho thấy môi trường phù hợp nhấtlàMacConkey và môi trường thạch máudùng cho các loại cầu khuẩn tan máu, không chứa thành phần ức chế vi khuẩn hiếu khí.
Sử dụng chủng chuẩn A.brasiliensis ATCC®16404TM xác định môi trường không có chứa thành phần ức chế nấm mốc phát triển.Kết quả cho thấy môi trường SA (Sabouraud) rất thích hợp cho nấm mốc trong không khí phát triển.
2.2. Lấy mẫu vi sinh vật trong không khí
Không khí được hút vào và va đập vào bề mặt thạch đặt bên trong thiết bị. Cỡ mẫu lấy 3 điểm khác nhau phân bố đều trên mặt bằng 20 m2. Mẫu được lấy lặp lại 5 lần liên tiếp.Mẫu tái lặp được lấy trong ngày khác.Thể tích không khí nghiên cứu lần lượt là: 50 lít, 100 lít, 150 lít, 200 lít không khí.

Phương pháp đặt đĩa thạch (phương pháp Korch)được dùng để so sánh.Cỡ mẫu trong thí nghiệm được đặt ở 5 vị trí khác nhau, 4 ở xung quanh và một ở giữa.
2.3. Kết quả nghiên cứu đánh giá độ chính xác của phương pháp
2.3.1. Đánh giá độ lặp lại
Lấy mẫu lặp lại 5 lần liên tiếp. Xác định độ lệch chuẩn và hệ số biến thiên để đánh giá độ lặp lại của phương pháp. Kết quả nghiên cứu được thể hiện tại bảng 1 và bảng 2.
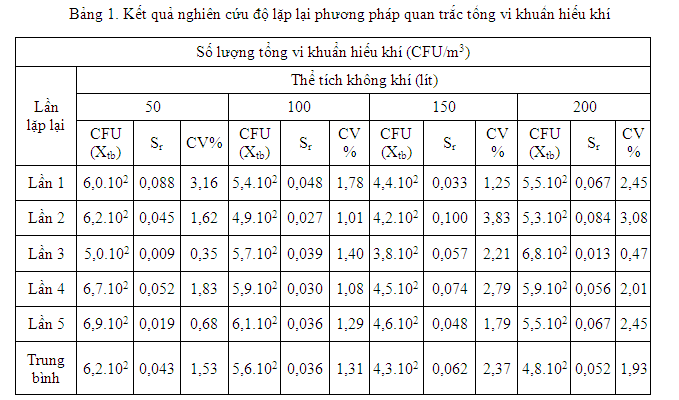
Kết quả bảng 1 cho thấy độ lệch chuẩn của 5 lần lặp lại biến thiên theo chiều tăng lượng thể tích không khí được lấy mẫu.Tuy nhiên,ở thể tích mẫu 100 lít không khí, độ lệch chuẩn và hệ số biến thiênlà nhỏ nhất (tương ứng là 0,036 và 1,31%).Vì vậy, thể tích 100 lít không khí là lượng thể tích lấy mẫu phù hợp nhấtđối với tổng vi khuẩn hiếu khí.
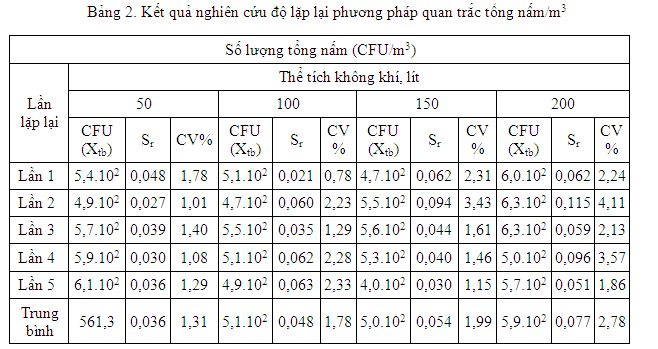
Bảng 2 cho thấy, với thể tích 50 lít không khí thì độ lệch chuẩn và hệ số biến thiên của 5 lần lặp lại là thấp nhất (tương ứng là 0,036 và 1,31%).Với thể tích 50 lít không khí,các bào tử nấm trong không khí bị va đập vào bề mặt thạch không chồng chéo lẫn nhau, dễ dàng đếm được số lượng nấm mốc trên bề mặt đĩa thạch có được độ chính xác cao hơn.
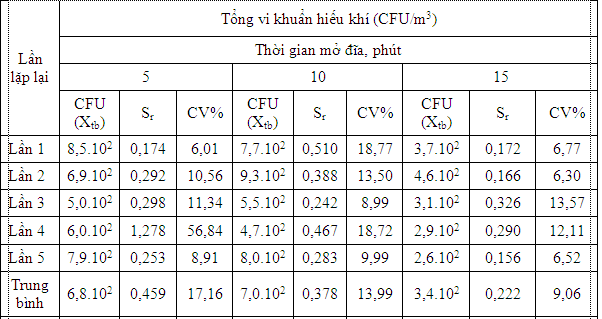
Để so sánh về độ chính xác và độ ổn định của phương pháp chủ động (dùng thiết bị lấy mẫu), thực hiện song song phương pháp cổ điển (đặt đĩa thạch). Kết quả xác định độ lệch chuẩn và hệ số biến thiên của phương pháp cổ điển được thể hiện ở bảng 3.
Bảng 3. Quan trắc tổng vi khuẩn hiếu khí bằng phương pháp đặt đĩa thạch
Bảng 4. Quan trắc tổng nấm trong không khí bằng phương pháp đặt đĩa thạch
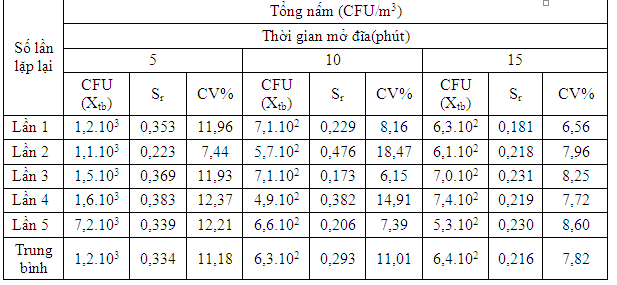
Kết quả bảng 3 và bảng 4 cho thấy dùng phương pháp đặt đĩa thạch không đạt được độ chính xác cần thiết.Nguyên nhân là do phương pháp đặt đĩa thạch phụ thuộc nhiều vào sự chuyển động không khí, thành phần hạt bụi; những hạt bụi đủ nặng mới có thể rơi vào đĩa thạch.
2.3.2. Đánh giá độ tái lặp
Thực hiện lấy mẫu trong nhiều điều kiện khác nhau. Trong nghiên cứu này độ tái lặp được xác định thực hiện lấy mẫu ngày hôm sau. Kết quả độ lệch chuẩn tái lặp của các lần lấy mẫungày khác nhau được biểu diễn trong bảng 5 và 6.
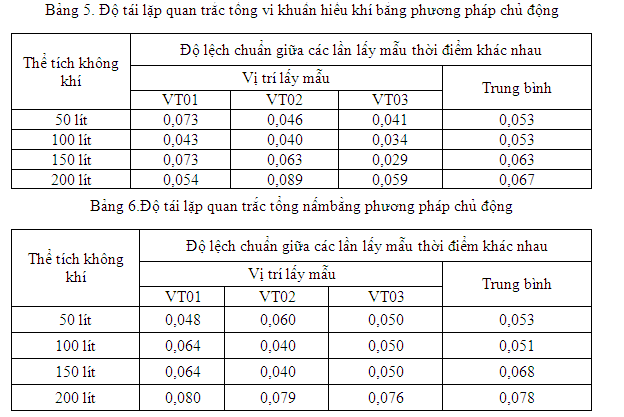
Bảng 5 và bảng 6 cho thấy độ lệch chuẩn tái lặp của các lần lấy mẫu ngày khác nhau đều < 0,1. Cho thấy phương pháp chủ động không bị các yếu tố về kỹ thuật, một số yếu tố khác trong quá trình lấy mẫu tác động nhiều. Kết quả quan trắc vi sinh vật trong không khí dùng phương pháp chủ động đảm bảo được tính chính xác cao.
2.3.3. Đánh giá độ ổn định
Độ ổn định thể hiện độ chính xác (độ đúng và độ chụm) chấp nhận được của phương pháp. Bảng 1 và bảng 2 cho thấy độ ổn định rất tốt, hầu hết các vị trí lấy mẫu trong một khu vực đều có kết quả gần như nhau, sai lệch kết quả giữa các lần quan trắc đều nhỏ hơn 15%. Trong khi đó, phương pháp đặt đĩa thạch cho kết quả sai lệch nhiều ở các lần quan trắckhác nhau (xem bảng 3 và bảng 4). Hình 2 là kết quả 5 lần lấy mẫu lặp lại liên tiếp.

2.3.4. Giới hạn phát hiện và giới hạn định lượng
Giới hạn phát hiện và giới hạn định lượng của phương pháp quan trắc vi sinh vật trong không khí chưa được xác định rõ ràng. Nghiên cứu này dựa trên các điều kiện khảo sát lượng mẫu lấy và độ chụm, độ chính xác của kết quả thực tế tính toán giới hạn phát hiện của phương pháp (LOD) và giới hạn định lượng (LOQ). Kết quả xác định được giới hạn phát hiện của phương pháp quan trắc tổng vi khuẩn hiếu khí trong không khí môi trường lao động là LOD = 0,108 và LOQ= 1 (CFU/m3) và giới hạn phát hiện của phương pháp quan trắc tổng nấm là LOD = 0,108 và LOQ = 1(CFU/m3) [5].
2.3.5. Độ không đảm bảo đo của phương pháp
Trong nghiên cứu này độ không đảm bảo đo thực hiện trên mẫu thật lập lại liên tiếp nhiều lần. Kết quả tính độ không đảm bảo đo của phương pháp tương ứng với lượng không khí được lấy mẫu được trình bày trong bảng 6.
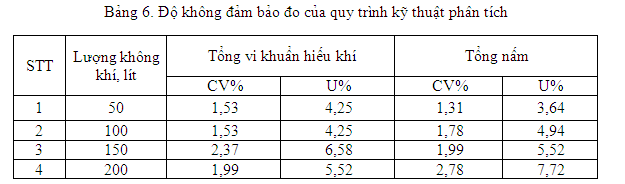
Ở thể tích không khí lấy mẫu 50 – 100 lít, thì độ không đảm bảo <5%. Độ không đảm bảo đo thể hiện sai số trong phép đo quan trắc vi sinh trong không khí là 5%.
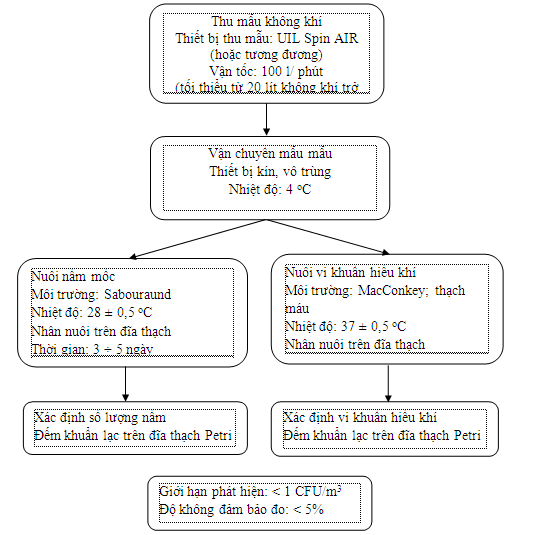
2. 4. Quy trình phân tích
Quy trình phân tích tổng vi khuẩn hiếu khí và tổng nấm trong không khí môi trường lao động như sau:
KẾT LUẬN
Nhiệm vụ đãxây dựng được quy trình phân tích nấm mốc và vi khuẩn hiếu khí trong không khí môi trường lao động, sử dụng thiết bị lấy mẫu chủ động. So với phương pháp đặt đĩa thạch thì phương pháp lấy mẫuchủ động có độ chính xác cao hơn và khả năng kiểm soát thể tích lấy mẫu.
Nhiệm vụ cũng đã khảo sát đánh giá được độ chính xác của phương pháp lấy mẫu trong quy trình phân tích bao gồm độ lặp lại, độ tái lặp, độ ổn định, giới hạn phát hiện, giới hạn định lượng và độ không đảm bảo. Phương pháp có giới hạn phát hiện LOD = 0,108 và LOQ= 1 (CFU/m3) và độ không đảm bảo của phương pháp là 5%.
TÀI LIỆU THAM KHẢO
- Nguyễn Lân Dũng, Phạm Thị Trân Châu, Nguyễn Thanh Hiền, Lê Đình Lương, Đoàn Xuân Mượu, 1978:Một số phương pháp nghiên cứu vi sinh vật học, Tập III, NXB Khoa học và Kỹ thuật, Hà Nội.
- Trịnh Quỳnh Mai, Nguyễn Thanh Thủy, Trần Quang Bình, Phan Trọng Lân, 2010: “So sánh kết quả phát hiện vi sinh vật trong không khí giữa phương pháp đặt đĩa thạch và sử dụng máy hút mẫu không khí”, Tạp chí Y học dự phòng, XX, 5 (113): 106-110.
- Nguyễn Quốc Tuấn (2009), Đề tài “Khảo sát ô nhiễm vi sinh trong không khí phòng phẫu thuật, phòng hồi sức ở một số bệnh viện tại thành phố hồ chí minh”, Viện Vệ sinh – Y tế công cộng thành phố Hồ Chí Minh.
- Đỗ Thị Phương Xuân, Trần Thị Hạnh Tiên, Lê Thị Ngọc Huệ (2011). “Khảo sát độ ô nhiễm nấm mốc trong không khí ở phòng là việc không dùng máy lạnh của trường học tại quận Bình Thạnh, thành phố Hồ Chí Minh. Nghiên cứu Y học – Y học TP Hồ Chí Minh, 15(1), 93 – 96.
- Trần Cao Sơn (2010). “Thẩm định phương pháp trong phân tích hóa học và vi sinh vật. NXB Khoa học và Kỹ thuật, Hà Nội.
- Ahmad Sayuti Zainal Abidin, A.M. Leman, Nor MorhRazif Noraini, M.D. Amir Abdullah, 2013: “Comparative Study on Airbone Microbe in Different Phases of Building Commissioning for Indoor Air Quality Improvement” ARPNJournal of Science and technology, 3(6).
- M.F. Yassin; S. Almouqate (2010). “Assessment of airborne bacteria and fungi in an indoor and outdoor environment. Int. J.Environ, Sci Tech,7(3), 535-544.
- Paul A. Jensen, PhD., PE, CIH and Millie P.. Schafer (1998). “Sampling and Characterization of bioaerosol”. NIOSH Manual of Analytical Methods.
- John G. Holt, Noel R. Krieg, Peter H. A. Sneath, James T. Staley and Stanley T. Wiliams, 1986:Bergey’s manual of Systematic Bacteriology, 9th Edition, 2.
- WHO (2009). Who guidelines for indoor air quality: Dampness and mould, ISBN 978 92 890 4168 3.
Vũ Duy Thanh
Viện Nghiên cứu Khoa học kỹ thuật Bảo hộ lao động
(Nguồn tin: Nilp.vn)
