Sự ô nhiễm vi sinh vật trong không khí, phương pháp kiểm tra và tiêu chuẩn đánh giá
Sự ô nhiễm vi sinh vật trong không khí là một trong những vấn đề cần được quan tâm khi đánh giá chất lượng môi trường không khí tại nơi làm việc. Việc chuẩn hóa các phương pháp lấy mẫu vi sinh trong không khí cũng như phương pháp đánh giá được các nhà khoa học, các tổ chức có uy tín trên thế giới nghiên cứu và ban hành; tuy nhiên vẫn chưa có sự thống nhất. Bài viết này nhằm tổng quan lại các vấn đề các phương pháp kiểm tra, đánh giá sự ô nhiễm vi sinh trong không khí trên cơ sở các tiêu chuẩn đã được ban hành và sửa đổi, dựa vào đó mà các cơ sở sản xuất có thể tham khảo để đánh giá chỉ tiêu vi sinh trong không khí khi ở Việt Nam vẫn chưa có những nghiên cứu đầy đủ để ban hành tiêu chuẩn này.
1. Mở đầu
Vi sinh vật tiềm ẩn trong môi trường không khí nơi diễn ra các hoạt động của con người và trở thành một yếu tố nguy cơ, đặc biệt là trong bệnh viên, trong công nghiệp nói chung và trong nông nghiệp. Những năm gần đây đã có nhiều nghiên cứu tiến hành thực hiện việc khảo sát sự nhiễm bẩn của vi sinh vật trong không khí trong môi trường làm việc và việc đánh giá mức độ nhiễm bẩn của vi sinh vật trong không khí ở một khu vực nguy cơ nào đó được xem như là một bước cơ bản của công tác phòng ngừa. Tuy nhiên, nhiều vấn đề liên quan đến phương pháp lấy mẫu, khảo sát, diễn giải các kết quả và tiêu chuẩn về mức độ ô nhiễm được chấp nhận vẫn đang trong quá trình nghiên cứu. Tại Việt Nam, sự ô nhiễm vi sinh vật trong không khí ở nhiều ngành nghề chưa được chú ý nhiều và tiêu chuẩn vi sinh vật trong không khí vẫn chưa được ban hành, gây khó khăn cho công tác kiểm tra, đánh giá nguy cơ ô nhiễm không khí của các tác nhân vi sinh tại nơi làm việc. Trong bài viết này, tác giả tổng quan về các phương pháp lấy mẫu vi sinh trong không khí, các cách đánh giá ô nhiễm vi sinh trong không khí đang được sử dụng trên thế giới để đọc giả tham khảo. Tuy nhiên, vấn đề ban hành tiêu chuẩn vi sinh vật trong không khí nơi làm việc vẫn là một mục tiêu lâu dài cần hướng tới.
2. Cách thức thu mẫu vi sinh vật trong không khí.
Hiện nay, cách thức hiệu quả để định lượng vi khuẩn trong không khí vẫn là đếm khuẩn lạc. Đếm khuẩn lạc trong không khí không phải là một công việc đơn giản; có nhiều phương pháp khác nhau đã được sử dụng và chia thành 4 nhóm chính:
– Đếm khuẩn lạc hình thành (Colony forming unit- CFU) trong 1m3 không khí: (cfu/m3).
– Đếm số khuẩn lạc hình thành (Colony forming unit- CFU) trên các đĩa.
– Khảo sát thành phần hóa học của các tế bào vi khuẩn trong 1 m3 không khí.
– Đếm vi sinh vật dưới kính hiển vi.
Việc khảo sát các thành phần hóa học của các tế bào vi khuẩn (ví dụ như khảo sát năng lượng ATP, khảo sát gen hoặc các loại enzyme) vẫn chưa được xem là phương pháp đáng tin cậy và có tính thực tiễn khi sử dụng để nghiên cứu vi sinh trong không khí. Đếm dưới kinh hiển vi hoặc là đếm tự động trên hệ thống huỳnh quang như hệ thống fly cytometry hoặc là phương pháp lai tại chỗ in situ có huỳnh quang hiện đang được ứng dụng khá hạn chế và còn đang tiếp tục được nghiên cứu. Phương pháp đếm khuẩn lạc hình thành đang được sử dụng phổ biến nhất, tuy nhiên cũng có nhiều vấn đề chưa được thống nhất.
Việc thu mẫu không khí để khảo sát vi sinh vật hiện nay có thể được tiến hành theo hai cách: theo phương pháp lấy mẫu chủ động và phương pháp lấy mẫu thụ động (phương pháp đặt đĩa). Cả hai phương pháp này đều được sử dụng rộng rãi, tuy nhiên phương pháp nào cũng có những ưu điểm và nhược điểm riêng.
2.1 Phương pháp lấy mẫu chủ động.
Ô nhiễm vi sinh trong không khí có thể khảo sát được thông qua việc đếm số khuẩn lạc hình thành trong 1m3 không khí (cfu/m3). Người ta sử dụng phương pháp lấy mẫu chủ động bằng cách thu nhận một thể tích không khí nhất định đã được biết trước và thổi qua môi trường dinh dưỡng bằng các kỹ thuật khác nhau. Có nhiều công cụ lấy mẫu không khí được bán trên thị trường mà mỗi công cụ được thiết kế khác nhau có thể tạm chia thành 7 nhóm, bao gồm: (1) nhóm lấy mẫu sử dụng các ống impinger, (2) nhóm lấy mẫu sử dụng các impactor dạng khe (slit – type), (3) nhóm sử dụng các impactor dạng sàng (sieve type), (4) nhóm lấy mẫu có màng lọc, (5) nhóm lấy mẫu ly tâm, (6) nhóm phương pháp lắng tĩnh điện, (7) nhóm phương pháp tụ nhiệt. Tiêu chuẩn chính thống đối với không khí về cơ bản cũng dựa trên việc khảo sát số cfu/m3. Tuy nhiên, có nhiều phản hồi cho thấy rằng rất khó có thể giải thích một cách đúng đắn kết quả thu được từ các thiết bị này.
Cùng một công cụ lấy mẫu cho ra các kết quả khác nhau dù mẫu được lấy ở cùng một nơi và cùng một thời điểm, cho thấy có sự sai khác rất lớn. Các dụng cụ lấy mẫu khác nhau lại cho ra các kết quả khác nhau. Điều đó có nghĩa là không thể so sánh các dữ liệu thu được khi sử dụng các công cụ lấy mẫu khác nhau. Nhiều bài báo đã được công bố mà qua đó đã đánh giá và so sánh các hiệu quả của các công cụ lấy mẫu khác nhau. Kết quả có một điểm chung là số lượng khuẩn lạc đếm được khác nhau khi sử dụng công cụ, thiết bị khác nhau. Như vậy rõ ràng là khó có thể lựa chọn được thiết bị nào là đúng để sử dụng.
Chẳng hạn như một số nghiên cứu chứng tỏ rằng công cụ lấy mẫu không khí dạng impactor như Andersen thu được số lượng các vi sinh vật cao hơn đáng kể nhưng thiết bị Andersen 8 thì tốt hơn thiết bị Andersen 2 thì [11]. Ngoài ra, Lembke phàn nàn về những sai khác quá lớn khi sử thiết bị lấy mẫu Andersen 6 [6] . Ở nơi có nồng độ vi sinh cao hơn 1000 cfu/m3 thì impinger AG30 cho kết quả đếm khuẩn lạc cao gấp 6 lần so với phương pháp qua màng lọc gelatin (Gelatin membrane filtration – GMF) [10], trong khi đó thiết bị lấy mẫu ly tâm Reuter (Reuter Centrifugal Sampler – RCS) cho thấy hiệu quả hơn thiết bị lấy mẫu có cắt khe hay impinger lỏng [1]. Khi so sánh phương pháp RCS với phương pháp lấy mẫu SAS (surface air system- SAS) thấy có kết quả tương tự: thiết bị lấy mẫu RCS cho kết quả đếm khuẩn lạc cao hơn gấp 3-4 lần so với hệ thống SAS [8]. Khảo sát bằng thiết bị SAS super 90 và RCS cho thấy thấp hơn hẳn so với sử dụng thiết bị Andersen 2 thì hay thiết bị Burkard. Verhoeff và cộng sự có tổng hợp lại những kết quả khác nhau khi sử dụng các thiết bị lấy mẫu khác nhau khi liệt kê và định dạng nấm mốc. Việc so sánh được thực hiện bằng cách so kết quả của 5 thiết bị lấy mẫu trên thị trường hiện nay (là thiết bị lấy mẫu có khe thạch, N6 – Anderson, SAS, RCS và thiết bị lấy mẫu lọc gelatin) kết hợp với 4 môi trường nuôi cấy. Kết quả cho thấy kết quả có sự sai khác lớn ở tất cả các phương pháp. Kết quả thống kê cho thấy thiết bị lấy mẫu cắt khe và N6 Andersen kết hợp với DG 18% (dichloran 18% glycerol agar) và MEA (malt extract agar) cho kết quả cao nhất [14].
|
|
|
Thiết bị lấy mẫu dạng ly tâm RCS |
Thiết bị lấy mẫu không khí bề mặt |
|
Thiết bị thu mẫu sử dụng các impinger |
Lấy mẫu sử dụng màng lọc |
Hình 1: Hình minh họa một số công cụ lấy mẫu không khí bằng phương pháp chủ động.
Ngoài các nhược điểm không thống nhất về số liệu khảo sát khi so sánh kết quả, thiết bị lấy mẫu chủ động còn rất đắt tiền, nặng, gây tiếng ồn và khó tuyệt trùng. Chúng thường xuyên phải hiệu chỉnh và thể tích của không khí thu được không tương thích với mong đợi. Một hạn chế nữa của lấy mẫu chủ động là giới hạn về kích cỡ mẫu không khí. Điển hình là thiết bị lấy mẫu có khe thạch có dung tích lấy mẫu là 80 L/phút. Nếu 1m3 không khí được kiểm tra thì nó yêu cầu thời gian là 15’. Mặc dù có những thiết bị lấy mẫu được cho là có khả năng lấy mẫu với thể tích lớn hơn nhưng cần phải xem xét những tình huống như tạo ra sự nhiễu loạn vùng không khí cần được khảo sát tại thời điểm, qua đó tạo ra sự nhiễu loạn nhân tạo và làm thay đổi số lượng khuẩn lạc đếm được. Hơn nữa, vi sinh vật sống có thể bất hoạt trong quá trình lấy mẫu do tương tác với thiết bị hoặc với môi trường nuôi cấy.
Tuy nhiên, tất cả các qui định chính thống để kiểm soát các vi sinh vật trong không khí chủ yếu đều dựa trên số lượng khuẩn lạc trong 1m3 không khí mà không có phân biệt loại thiết bị lấy mẫu nào được sử dụng. Đây là một vấn đề quan trọng cần chú ý vì các thiết bị lấy mẫu chủ động trên thị trường rất khác nhau về hiệu suất làm việc.
Tại Hoa Kỳ, tiêu chuẩn đầu tiên đối với việc khảo sát các thành phẩn ô nhiễm trong không khí được ban hành là Tiêu chuẩn liên bang 209E (Federal Standard 209E). Sau này, tiêu chuẩn FS209E đã được thay thế bằng tiêu chuẩn ISO 14644 với nhiều nội dung được cải tiến [15].
Theo tài liệu của CEN/TC 243, việc lựa chọn thiết bị lấy mẫu cần phải tính toán đến các tiêu chuẩn như sau: (a) Khả năng phát hiện được ô nhiễm vi sinh vật trong không khí ở mức độ thấp với kết quả đáng tin cậy, (b) tốc độ dòng phù hợp với mục tiêu (a), (c)Tốc độ dòng không khí/tương tác phù hợp, (d) thể tích không khí đặc trưng có thể lấy được; (e) môi trường nuôi cấy phù hợp; (f) trọng lương/kích thước thiết bị dễ thao tác; (g) thiết bị dễ vận hành, (h) thiết bị dễ dàng vệ sinh, không lây lan và khử trùng được; (i) thiết bị phải được công nhận về việc chuẩn hóa [3].
2.2 Phương pháp lấy mẫu thụ động (phương pháp đặt đĩa).
Ở phương pháp này, các đĩa petri có chứa môi trường nuôi cấy được đặt ở ngoài không khí trong một thời gian nhất định. Các vi sinh vật được mang vào môi trường nuôi cấy nhờ các phần tử trơ rơi vào bề mặt của đĩa với tốc độ trung bình khoảng 0,46 cm/s. Sau khi ủ ở 36±1oC thì chúng mọc thành khuẩn lạc tỷ lệ với sự nhiễm bẩn vi sinh vật trong không khí.
|
Đĩa RODAC |
Đĩa Petri |
Hình 2: Một số loại đĩa thủy tinh chuyên dụng sử dụng trong phương pháp đặt đĩa
Nhược điểm chính của phương pháp đặt đĩa là không phải toàn bộ các vi sinh vật khảo sát đều rơi vào hoặc là có mối tương quan yếu với các khuẩn lạc xác định bởi các phương pháp định lượng khác và với thể tích không khí xung quanh xác định. Vì vậy mà việc lấy mẫu theo trọng lực hoặc là theo quá trình dịch chuyển này được xem là phương pháp thu mẫu không định lượng và phương pháp này bị ảnh hưởng bởi kích cỡ và hình dạng của phân tử và bởi sự di chuyển của không khí xung quanh. Thể tích không khí từ các phần tử ban đầu là không thể biết trước. Kết quả thu được từ phương pháp lấy mẫu theo trọng lực khi không định lượng chính xác hoặc là không so sánh được với các phương pháp lấy mẫu khác. Ngoài ra, thời gian đặt đĩa kéo dài từ 15 phút tới 1h hoặc hơn.So với phương pháp lấy mẫu chủ động, phương pháp lấy mẫu thụ động (đặt đĩa) có ưu điểm là các đĩa sử dụng có thể tuyệt trùng, tiết kiệm vì có thể sử dụng nhiều lần, giá thành rẻ và dễ sử dụng. Các kết quả thu được từ các đĩa đặt có tính lặp lại và đáng tin cậy. Hơn nữa, nhiều địa điểm trong môi trường có thể kiểm tra được trong cùng một thời điểm và dữ liệu thu được từ các đĩa đặt ở những vị trí khác nhau có thể so sánh được với nhau. Ngoài ra, khuynh hướng tự nhiên của quần thể vi sinh vật trong không khi không bị nhiễu loạn trong quá trình lấy mẫu hoặc không bị dòng không khí cản trở. Phương pháp đặt đĩa có thể dùng để khảo sát các thành phần có hại của vi khuẩn rơi trên bề mặt ở một thời điểm xác định, do đó kết quả còn có thể đánh giá được sự nhiễm bẩn bề mặt từ không khí. Chính vì có nhiều ưu điểm nổi trội hơn hẳn so với phương pháp lấy mẫu chủ động nên phương pháp đặt đĩa được khuyến cáo sử dụng nhiều trong các tiêu chuẩn về vi sinh không khí được ban hành.
3. Những tiêu chuẩn về vi sinh trong không khí được đề xuất
Friberg và cộng sự đề xuất rằng phương pháp đặt đĩa có thể cho các dữ liệu về sự ô nhiễm vi sinh ở bề mặt và phương pháp này thực tiễn và các chỉ số tương ứng về tỷ lệ nhiễm bẩn không khí thực tế hơn là phương pháp đếm khuẩn lạc bằng phương pháp chủ động. Trong nghiên cứu này, nhóm tác giả có đề xuất tiêu chuẩn vi sinh trong phòng sạch tại Anh quốc là < 10 cfu/m3 [5].
Nhóm tác giả Pasquarella và cộng sự có tiến hành nghiên cứu so sánh về độ tin cậy của dữ liệu thu được từ phương pháp đặt đĩa với dữ liệu thu được từ 2 phương pháp lấy mẫu thụ động là SAS- Surface Air System (Pool Bioanalysis Italian) và RCS – Reuter Centrifugal Sampler (Folex-Biotest). Việc khảo sát vi sinh vật trong môi trường với mức độ nhiễm bẩn khác nhau và số mẫu thu được như nhau ở cùng một địa điểm và cùng thời gian đối với cả ba phương pháp. Kết quả cho thấy phương pháp đặt đĩa cho số liệu có độ lệch chuẩn thấp nhất so với hai phương pháp còn lại [9].
Tuy nhiên, phương pháp đặt đĩa cũng có những nhược điểm chưa được thống nhất và phương pháp này đang được sử dụng với nhiều cách thức rất khác nhau. Đĩa petri sử dụng với đường kính khác nhau, thời gian đặt đĩa khác nhau, môi trường nuôi cấy khác nhau, thậm chí thời gian ủ và nhiệt độ ủ cũng khác nhau do đó dẫn đến việc khó so sánh các dữ liệu thu được do những cách thức khác nhau này.
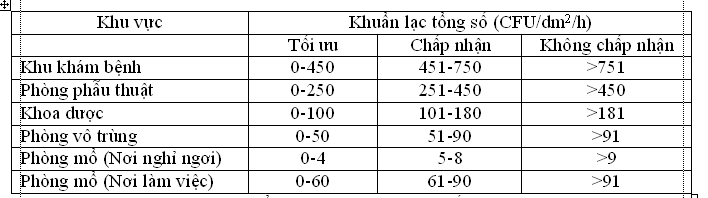
Tiêu chuẩn vi sinh vật đầu tiên dựa trên phương pháp đặt đĩa được đề xuất bởi Fisher trong những năm 1970 và sau đó chính nhóm nghiên cứu của ông cũng đã theo đuổi việc nghiên cứu đề xuất tiêu chuẩn vi sinh và công bố các bài báo về tiêu chuẩn này vào những năm sau đó. Trong nghiên cứu đầu tiên, nhóm nghiên cứu thực hiện nhằm mục đích xác định các thông số và phương pháp lấy mẫu tốt nhất. Sử dụng đĩa petri 9cm và thạch máu, sau 24h ủ ở 37oC và chuyển kết quả theo đơn vị tính là cfu/dm2, kết quả nghiên cứu của ông cho thấy sự nhiễu loạn của không khí không làm ảnh hưởng tới kết quả đếm khuẩn lạc trên đĩa. Với cách đặt đĩa trong môi trường không khí trong vòng 1h và để chúng cách nền đất từ 80-100 cm, cách tường 100-150 cm, nhóm nghiên cứu đã thu được các giá trị trung bình rất hữu ích để đánh giá được sự ô nhiễm vi sinh vật trong môi trường không khí. Sau đó, từ nghiên cứu này mà qui trình 1/1/1/ đã được đề xuất là tiêu chuẩn để khảo sát sự ô nhiễm vi sinh trong không khí trong bệnh viện: đĩa petri đặt trong môi trường không khí trong 1h, cách sàn 1m và cách tường 1m. Sau đó, ông có công bố về các mức nhiễm vi sinh trong không khí được chấp nhận ở các khu vực khác nhau của bệnh viện với mức đánh giá nguy cơ về vi sinh khác nhau như sau [9]:
Bảng 1: Đếm tổng vi sinh vật trong không khí theo Fisher tại các khu vực khác nhau của bệnh viện (số CFU trên đĩa petri đường kính 9 cm, thạch máy, đặt trong môi trường không khí theo qui trình 1/1/1).
Tuy nhiên, theo tiêu chuẩn của NASA sử dụng đối với phòng sạch và khu vực làm việc để kiểm soát vi sinh vật trong môi trường thì việc đếm khuẩn lạc lại được tính theo đơn vị là cfu/m3. Việc lấy mẫu lại sử dụng các đĩa Petri kích thước 73,5 cm2 đặt trong không khí trong 1h và 2h, vị trí đặt trong 1m2 trong thời gian 1 tuần [7] . Ngoài ra, theo tiêu chuẩn CEN/ISO của Châu Âu về hướng dẫn thực hiện sản xuất sạch GMP (EU Guide to Good Manufacturing Practice) thì cần phải tính tới cả vi sinh vật trên tay, trên các bề mặt và trong không khí. Do đó mà đưa ra các mức độ sạch tăng giảm theo các mức A, B, C, D; tương ứng với mỗi mức độ thì tiêu chuẩn được tính theo đơn vị là số phần tử/m3 không khí, số cfu/m3 không khí, số cfu/đĩa 9cm để trong không khí trong 4h, số cfu/ đĩa RODAC và số cfu/găng tay, theo bảng như sau:
Bảng 2: Giới hạn ô nhiễm vi sinh trong không khí theo tiêu chuẩn GMP của Châu Âu [4]
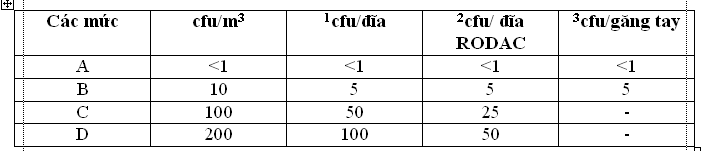
Ghi chú:
1Đặt đĩa 9cm trong không khí trong 4h
2Đối với bề mặt thì dùng đĩa tiếp xúc RODAC, 55cm
3Số cfu trên tay có đeo găng đã khử trùng.
Như vậy, rõ ràng là vẫn chưa có sự thống nhất về phương pháp đặt đĩa. Do vậy mà các nhà khoa học thuộc phòng Vệ sinh của trường đại học Perugia đã công bố về phương pháp giám sát vi sinh trong môi trường không khí (Microbial environmental monitoring) mà họ đã nghiên cứu. Đó là một hệ thống giám sát vi sinh ở bất kì khu vực làm việc nào có nguy cơ bị phơi nhiễm với vi sinh vật. Phần cơ bản của hệ thống này là lập kế hoạch giám sát vi sinh không khí mà qua đó có thể thiết lập được chỉ số phơi nhiễm vi sinh (The Index of Microbial Air contamination-IMA) thông qua chỉ số này, các nhà nghiên cứu hy vọng có thể thống nhất được phương cách thức lấy mẫu và tính toán kết quả theo dựa theo phương pháp đặt đĩa.
Phương pháp khảo sát IMA đơn giản, sử dụng đĩa petri 9cm và môi trường nuôi cấy PCA (plate count agar) đặt ngoài không khí theo qui trình 1/1/1. Sau thời gian ủ 48h ở 36±1oC thì tiến hành đến khuẩn lạc, số khuẩn lạc chính là số IMA. Chỉ số IMA có thể sử dụng để khảo sát vi sinh không khí ở nhiều môi trường khác nhau như trong bệnh viện, trong nhà, các trường học, viện nghiên cứu, các xưởng công nghiệp, ngoài trời, bảo tàng, thư viện [9]. Nếu căn cứ theo chỉ số IMA thì có 5 mức đánh giá đối với vi sinh trong không khí như bảng sau:
Bảng 3: Các mức của chỉ số IMA và cách áp dụng

Tại Việt Nam, việc nghiên cứu sự ô nhiễm vi sinh vật trong không khí hiện nay chủ yếu dừng lại ở mức độ khảo sát để nắm được thực trạng và về cơ bản phương pháp được sử dụng là phương pháp lắng bụi của Kock (phương pháp đặt đĩa) [2],[12],[13]. Phương pháp này vẫn hạn chế ở mức đánh giá vi sinh không khí ở phòng sạch (có yêu cầu nghiêm ngặt và giới hạn vi sinh ở mức thấp như phòng xét nghiệm, bệnh viện…) [2] , do đó việc áp dụng để khảo sát vi sinh không khí ở nhiều môi trường khác nhau như trong nhà, xưởng công nghiệp,.. và ngoài trời nếu chỉ dựa trên tiêu chuẩn đánh giá của Kock sẽ có những bất cập; chẳng hạn như ở môi trường trong nhà xưởng với độ thông thoáng hạn chế, (đặc biệt là các cơ sở sản xuất lương thực, thực phẩm) thì mức độ ô nhiễm vi sinh có thể sẽ ít hơn, tiêu chuẩn phải nghiêm ngặt hơn những công ngoài trời với độ thông thoáng hơn, mật độ vi sinh có thể cao hơn nhưng tiêu chuẩn đánh giá có thể sẽ có phần ít nghiêm ngặt hơn. Tuy nhiên, hạn chế hiện tại là chúng ta vẫn chưa có nhiều nghiên cứu về sự ô nhiễm vi sinh trong nhà xưởng, do đó mà chưa có đầy đủ thông tin để có thể đưa ra những đề xuất về tiêu chuẩn vi sinh không khí phù hợp.
4. Kết luận
Như vậy, trên thế giới đã có nhiều nỗ lực để tiêu chuấn hóa việc đánh giá vi sinh vật trong không khí vùng làm việc, điều này quan trọng vì không những là một trong những tiêu chuẩn đánh giá chất lượng môi trường không khí trong lao động mà còn là một tiêu chí kiểm soát chất lượng sản phẩm. Tuy nhiên, tại Việt Nam, hiện nay chúng ta chưa ban hành được tiêu chuẩn vi sinh vật trong không khí ở các ngành nghề. Việc chưa ban hành được tiêu chuẩn vi sinh vật trong không khí gây khó khăn cho việc kiểm soát chất lượng không khí, đặc biệt là chất lượng không khí trong môi trường làm việc, do đó rất khó có thể có những phương án phòng ngừa sự lây lan của vi sinh vật có hại trong không khí, ảnh hưởng tới chất lượng sản phẩm, tới quá trình sản xuất và sức khỏe của người lao động. Như vậy, trên cơ sở tham khảo những tiêu chuẩn vi sinh không khí đã được ban hành ở một số quốc gia, chúng ta cần sớm có những nghiên cứu để ban hành những tiêu chuẩn vi sinh không khí (cả về phương pháp và tiêu chuẩn áp dụng) để dễ dàng hơn trong việc đánh giá chất lượng môi trường không khí nơi làm việc.
TÀI LIỆU THAM KHẢO
- A M Placencia, J T Peeler, G S Oxborrow, and J W Danielson. “Comparison of bacterial recovery by Reuter centrifugal air sampler and slit-to-agar sampler.” Appl Environ Microbiol 44, no. 2 (1982): 512-513.
- Bộ, y tế. Thường quy kỹ thuật Y học lao động và Vệ sinh môi trường, Sức khỏe trường học. Viện Y học lao động và vệ sinh môi trường, 2002.
- CEN/TC 243/WG 2N 52E. Clean Room Technology. Methods of Analyzing and Measuring Aerobic Contamination in Areas at Risk.
- European Good Manufacturing Practices (EU GMP). Guide to Manufacture of Sterile Medicinal Products, 1997.
- Friberg B, Friberg S, Burman LG. Inconsistent correlation between aerobic bacterial surface and air counts in operating rooms with ultra clean laminar air flows: proposal of a new bacteriological standard surface contamination. J Hosp Infect. 42(1999):287–293.
- L L Lembke, R N Kniseley, R C van Nostrand, and M D Hale. “Precision of the all-glass impinger and the andersen microbial impactor for air sampling in solid-waste handling facilities.” Appl Environ Microbiol. 1981 Aug; 42(2): 222–225. 42, no. 2 (1981): 222-225.
- National Aeronautics and Space Administration. NASA Standards for Clean Rooms and Work Stations for the Microbially Controlled Environment. NHB 5340.2. Washington, DC 20546, 1967
- Mehta SK, Mishra SK, Pierson DL. “Evaluation of three portable samplers for monitoring airborne fungi.” Appl Environ Microbiol 62, no. 5 (1996): 1835-1838.
- Pasquarella C, Pitzurra O, Savino A. “The index of microbial air contamination.” J Hosp Infect 46, no. 4 (2000): 241-246.
- Radmore, K, Luck, H. “Microbial contamination of dairy factory air.” South African journal of dairy technology 16, no. 3 (1984).
- S. E. Curtis, R. K. Balsbaugh, and J. G. Drummond. “Comparison of Andersen Eight-Stage and Two-Stage Viable Air Samplers.” Appl Environ Microbiol 35 (1978): 208-209.
- TCVN, 5376-1991. Trại chăn nuôi, phương pháp kiểm tra vệ sinh.
- Tuấn, Nguyễn Quốc. “Khảo sát ô nhiễm vi sinh vật trong không khí tại phòng phẫu thuật, phòng hồi sức ở một số bệnh viện tại Tp. Hồ Chí Minh.” Tạp chí Y học Tp. Hồ Chí Minh 14, no. 2 (2010): 173-179.
- Verhoeff AP, van Wijnen JH, Boleij JS, Brunekreef B, van Reenen-Hoekstra ES, Samson RA. “Enumeration and identification of airborne viable mould propagules in houses. A field comparison of selected techniques.” Allergy 45, no. 4 (1990): 275-284.
- http://www.iest.org/Standards-RPs/ISO-Standards/ISO-14644-Standards#ISO%2014644%20Standards
Ngô Thị Mai
Phân Viện Bảo hộ lao động và bảo vệ môi trường miền Nam
(Nguồn tin: Nilp.vn)