Xây dựng quy trình kỹ thuật định lượng axit mandelic – sản phẩm chuyển hóa của ethylbenzen trong nước tiểu bằng phương pháp sắc ký lỏng khối phổ
I. ĐẶT VẤN ĐỀ
Ethylbenzen là tác nhân gây bệnh nghề nghiệp đã được công nhận tại Việt Nam và nhiều nước trên thế giới. Theo American Conference of Governmental Industrial Hygienists (ACGIH2018) của Mỹvà nhiều nước trên thế giới đang sử dụng hai sản phẩm chuyển hóa của ethylbenzen trong nước tiểu làm chỉ số giám sát sinh học đó là chỉ số axit mandelic (MA) và axit phenylglyoxylic (PGA)[1],[2].
Tuy nhiên, hiện nay ở Việt Nam, chưa sử dụng chỉ số giám sát sinh học cho những người lao động có tiếp xúc nghề nghiệp với ethylbenzen do còn thiếu các quy trình phân tích định lượng các chỉ số giám sát sinh học. Để góp phần bảo vệ sức khỏe người lao động có tiếp xúc với ethylbenzen thì cần thiết phải xây dựng được các quy trình phân tích định lượng các chỉ số giám sát sinh học này. Vì vậy, cần nghiên cứu “Xây dựng quy trình kỹ thuật phân tích định lượng axit mandelic – sản phẩm chuyển hóa của ethylbenzen trong nước tiểu bằng phương pháp sắc ký lỏng khối phổ”, với mục tiêu là: xây dựng được quy trình kỹ thuật phân tích MA trong nước tiểu bằng phương pháp sắc ký lỏng khối phổ với độ chính xác trên 95%, giới hạn phát hiện nhỏ hơn 0,1µg/mL. Từ đó, đề xuất Bộ y tế xem xét sử dụng chỉ số giám sát sinh học cho người lao động có tiếp xúc nghề nghiệp với ethylbenzen.
II. ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Đối tượng nghiên cứu
Quy trình phân tích MA niệu – chuyển hóa của ethylbenzen trong nước tiểu của người lao động có tiếp xúc nghề nghiệp.
2.2.Phương pháp nghiên cứu
–Tiến hành theo phương pháp nghiên cứu thực nghiệm trong phòng thí nghiệm của Viện Khoa học ATVSLĐ bằng cách ứng dụng theo Phương pháp phân tích được xây dựng theo tài liệu của Laboratory Procedure Manual – The Centers for Disease Control and Prevention (CDC-2012)[3].
– Khảo sát trong phòng thí nghiệm: xây dựng quy trình, phân tích mẫu thực nghiệm
– Lấy mẫu ngoài hiện trường: lấy mẫu nước tiểu của người lao động tại nơi làm việc
2.3. Phương pháp kỹ thuật thực hiện:
2.3.1. Xây dựng quy trình: thử nghiệm ứng dụng phương pháp phân tích sắc ký với các điều kiện:
– Thiết bị: Máy sắc ký lỏng ba lần tứ cực LC/MA, nhãn hiệu HPLC 1290/MSD6430B của Agilent, Tủ âm sâu 860C,…
– Dụng cụ: Các dụng cụ chuyên dùng như bình định mức, pipet, cột C18 dài 150mm, đường kính 2,1 µm, kích thước hạt 1.8 µm,…
– Hóa chất: Hóa chất sử dụng trong đề tài của hãng Sigma đảm bảo độ tinh khiết để phân tích lượng vết nhưMA; Ammonium acetate; Methanol; Acetonitril,Axit acetic…
– Phương pháp phân tích được xây dựng theo tài liệu của Laboratory Procedure Manual – The Centers for Disease Control and Prevention (CDC-2012)[3] với các điều kiện cơ bản như: Pha động là Ammonium acetate (15mM) và Acetonitril, với tỷ lệ thay đổi trong thời gian phân tích 9 phút…
2.3.2. Xác định sản phẩm chuyển hóa: xác định bằng quy trình xây dựng được trên máy sắc kí lỏng khối phổ của Agilent.
III. KẾT QUẢ VÀ BÀN LUẬN
3.1. Kết quả xây dựng quy trình
3.1.1.Chuẩn hóa các điều kiện cho phép đo
Để chọn được các điều kiện tối ưu cho xây dựng quy trình, chúng tôi cần tiến hành khảo sát, đánh giávà thu được kết quả của từng điều kiện như dưới đây:
3.1.1.1. Hóa chất và dung dịch chuẩn
Sau khi cố định các điều kiện theo phương pháp tham khảo của CDC (2012). Chúng tôi tiến hành khảo sát để có thành phần pha động là tốt ưu nhất cho phương pháp phân tích với thiết thiết bị của phòng thí nghiệm máy HPLC 1290/MSD6430D(của Agilent). Kết quả khảo sát thành phần pha động được trình bày dưới đây:
Khảo sát nồng độ Ammonium acetate
Đối với quy trình phân tích MA thì dung dịch ammonium acetate được sử dụng làm pha động đồng thời là dung dịch xử lý mẫu. Để xác định được nồng độ ammonium acetate cho kết quả phân tích tốt nhất đề tài tiến hành khảo sát với dãy nồng độ ammonium acetate: 1; 5; 10; 15; 20 mM để xử lý mẫu chuẩn đồng thời làm pha động phân tích mẫu chuẩn luôn. Kết quả thu được ở bảng sau:
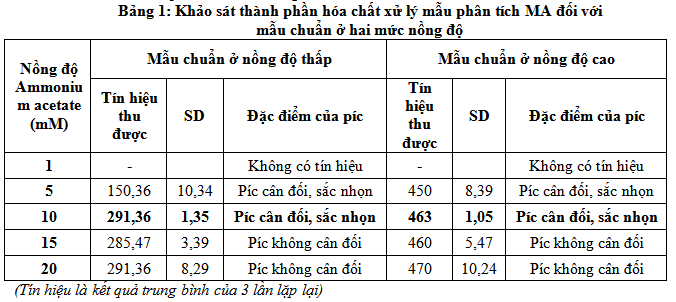
Kết quả khảo sát ở trên cho thấy tại nồng độ mmonium acetate 1mM cho thấy không phát hiện tín hiệu của MA. Nồng độ Ammonium acetate thấp không cung cấp đủ ion H+, không tạo được điều kiện để bắn phá ion trong phép phân tích, kết quả không phát hiện tín hiệu của MA.
Đối với nồng độ Ammonium acetate 5 mM cho thấy có tín hiệu, píc cân đối, đẹp, tuy nhiên tín hiệu lại rất thấp, không ổn định SD rất lớn 10,34.
Đối với nồng độ Ammonium acetate 10 mM cho thấy có tín hiệu cao nhất, píc cân đối, sắc nhọn và rất ổn định SD thấp (1,35) ở nồng độ thấp và 1,05 ở nồng độ cao.
Đối với nồng độ Ammonium acetate 15 mM cho tín hiệu cao 285,47nhưng thấp hơn đối với tín hiệu thu được ở nồng độ Ammonium acetate 10mM, píc không cân đối và SD lớn 3,39.
Đối với nồng độ Ammonium acetate 20mM cho thấy có tín hiệu cao nhưng píc không cân đối, không ổn định. Ở nồng độ ammonium acetate 20mM lượng muối sử dụng nhiều hơn gấp 2 lần so với ammonium acetate 10mM, trong phân tích của hệ thống sắc ký lỏng muối sử dụng càng nhiều càng ảnh hưởng đến tuổi thọ của cột, bẩn MS…
Với kết quả khảo sát thu được đề tài chọn ammonium acetate 10mM là nồng độ cho pha động và sử dụng để xử lý mẫu trong quy trình phân tích MA niệu.
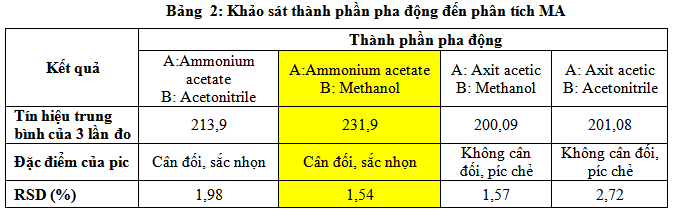
Phương pháp chúng tôi đã tham khảo pha động được sử dụng là A:Ammonium acetate B: Acetonitrile(ACN). Tuy nhiên để đạt được điều kiện phân tích tối ưu đề tài có khảo sát một số thành phần pha động khác nhau và kết quả thu được như ở bảng trên. Tại bảng 2 ở trên cho thấy với thành phần pha động là ammonium acetate và methanol cho tín hiệu phép phân tích là cao nhất, píc đẹp nhất (cân đối và sắc nhọn), tức là methanolcó khả năng rửa giải – tách MA ra khỏi cột tốt hơn ACN. Chính vì vậy đề tài chọn thành phần pha động cho phép đo là Ammonium acetate và Methanol.
* Kết quả khảo sát tỷ lệ pha động giữa các kênh
Tỷ lệ pha động là một trong những ảnh hưởng có tính chất quyết định đến kết quả của phép phân tích, để có tỷ lệ pha động cho kết quả tốt nhất đề tài tiến hành khảo sát với các tỷ lệ các kênh khác nhau kết quả thu được ở bảng 3.
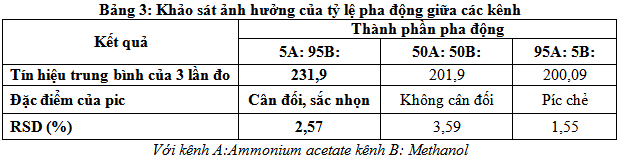
Kết quả khảo sát của đề tài cho thấy tại tỷ lệ pha động ban đầu là 5A: 95Btín hiệu phép đo là tốt nhất và nổi trội hơn hẳn so với các tỷ lệ pha động còn lại, chính vì vậy đề tài quyết định chọn tỷ lệ pha động cho phân tích MA là 5:Ammonium acetate kênh 95: Methanol
Cũng tương tự như vậy, khảo sát các yếu tố khác, đề tài thu được một số điều kiện tối ưu nhất như sau:
– Hóa chất: MA; Ammonium acetate; Methanol của Sigma
– Dung dịch chuẩn: pha MA trong nước cất hai lần để được các nồng độ từ 0,01-5µg/ml.
– Pha động là: 5:Ammonium acetate (10mM) – kênh A; 95: Methanol – kênh B
3.1.1.2. Các thông số cài đặt trên máy LC/MS
Khi có được các điều kiện tối ưu ở trên đề tài tiếp tục khảo sát để có được điều kiện tối ưu nhất cho các thông số cài đặt trên LC/MS như sau:
*) Điều kiện trên LC
– Tốc độ dòng: 0,2 ml/phút
– Tỉ lệ dung môi: A: 5% B: 95%
– Thời gian chạy mẫu: 4 phút
– Thể tích bơm mẫu: 15 µl
– Nhiệt độ cột: 400C
*) Điều kiện MS
– Nguồn tạo ion: ESI
– Năng lượng ion hóa : 70eV
– Chạy chế độ: MRM
– Phổ m/z: 149/77 (Riêng mảnh phổ được lấy theo phương pháp của CDC – mảnh phổ này đã được rất nhiều nghiên cứu xác định đây là mảnh phổ đặc trưng cho MA)
3.1.2. Chọn các điều kiện lấy mẫu, xử lý mẫu để có dung dịch đo
3.1.2.1. Lấy mẫu
Mẫu nước tiểu được thu vào cuối ca của ngày làm việc cuối tuần. Thu từ 5 -10ml nước tiểu đựng vào ống thủy tinh có thể tích 15-20ml, loại ống chịu được điều kiện âm sâu (-800C). Bảo quản lạnh tại hiện trường, khi đưa về phòng thí nghiệm được bảo quản âm sâu trước khi phân tích[2].
3.1.2.2.Xử lý mẫu
Mẫu được xử lý với nhiều điều kiện khác nhau và nhóm nghiêm cứu thu được điều kiện cho kết quả tốt nhất là quy trình xử lý mẫu như dưới đây:
Mẫu được pha bằng dung dịch Ammonium acetate (10mM) với tỷ lệ 1 mẫu : 9 Ammonium acetate (10M), lắc đều lọc qua màng lọc 0,2µm.
Dung dịch chuẩn để xây dựng đường chuẩn được xử lý như mẫu phân tích ở các mức nồng độ: 0,01µg/ml; 0,1 µg/ml; 1µg/ml; 2µg/ml; 3µg/ml; 4µg/ml; 5µg/ml.
3.1.3. Đánh giá các điều kiện của quy trình
a) Khảo sát khoảng tuyến tính và xây dựng đường chuẩn
* Khảo sát khoảng tuyến tính
Khoảng nồng độ chất phân tích từ giới hạn định lượng đến giới hạn tuyến tính gọi là khoảng tuyến tính (dynamic range). Khoảng tuyến tính của mỗi nguyên tố phân tích ở mỗi vạch phổ khác nhau là khác nhau. Vạch phổ nào có độ hấp thụ càng nhạy thì khoảng tuyến tính càng hẹp[4], [5].
Đề tài tiến hành khảo sát khoảng tuyến tính của MA bằng cách: pha một dãy chuẩn của MA trong nước cất hai lần là: 0,01; 0,1; 1; 2; 3; 4; 5; 6; 7; 8(µg/mL).Kết quả thu được dưới đây:
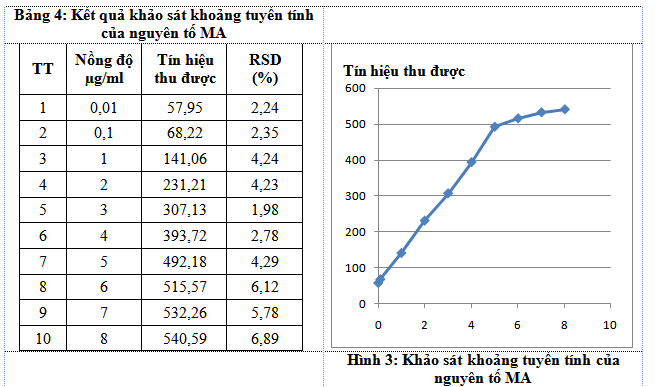
Kết quả khảo sát của đề tài cho thấy với nồng độ từ 6µg/ml trở lên thì tín hiệu thu được không tỷ lệ thuận với mức nồng độ tương ứng. Từ kết quả ở bảng trên đề tàinhận thấy khoảng tuyến tính của phương pháp phân tíchMA trong nước tiểu là từ LOQ-5µg/mL. Vì vậy khi phân tích mẫu nếu hàm lượng nguyên tố cần phân tích nằm ngoài khoảng tuyến thì phải làm giàu mẫu hoặc pha loãng mẫu để phân tích mới đảm bảo được độ chính xác của phép đo.
* Xây dựng đường chuẩn
Đường chuẩn
Từ kết quả khảo sát khoảng tuyến tính đề tài sử dụng phần mềm minitab 18.0 để xây dựng đường chuẩn. Phương trình đường chuẩn của MA trong nước tiểu được chỉ ra ở dưới đây:
Theo kết quả thu được từ phần mềm minitab 18.0 phương trình hồi quy đầy đủ của đường chuẩn cho phân tích MA trong nước tiểu có dạng: y=(56,8±16,81)+(85,6±2,93)x
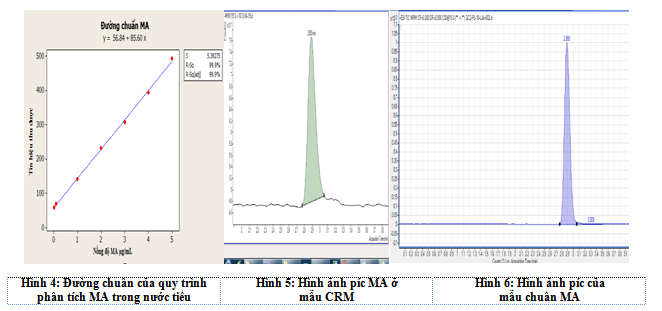
Đánh giá phương trình hồi quy của đường chuẩn
Để khẳng định phương pháp không bị mắc sai số hệ thống đề tàitiến hành kiểm tra hệ số a theo tiêu chuẩn thống kê Fisher (chuẩn F)[4], [5].
Nếu Ftính< Fchuẩn (F(0.95; 4; 5)) thì sự sai khác giữa giá trị a và 0 không có ý nghĩa thống kê và ngược lại. Kết quả đánh giá của đề tàicứu cho thấy Ftính = S’2/S2= 4,05; Fchuẩn = F(0,95;4;5) = 5,19,tức là Ftính< Fchuẩn ở phương trình đường chuẩn phân tích MAtrong nước tiểu. Có nghĩa là sự sai khác giữa giá trị a và 0 không có ý nghĩa thống kê. Vì vậy đề tàixác định phương pháp phân tích trên không mắc sai số hệ thống.
b) Giới hạn phát hiện (LOD), giới hạn định lượng (LOQ)
Đối với sắc ký thì việc xác định giới hạn phát hiện (LOD) và giới hạn định lượng (LOQ) dựa theo tỷ số tín hiệu/nhiễu đường nền là khá phổ biến[4], [5]. Đề tàisử dụng cách này để tính LOD, LOQ bằng cách thêm một lượng chất chuẩn nhỏ dần vào mẫu trắng và tại nồng độ 0,001µg/mLthu được tín hiệu cao gấp 3 lần so với tín hiệu đường nền.Như vậy theo phương pháp tính LOD dựa trên tỷ số tín hiệu/nhiễu đề tàithu được LOD=0,001µg/mL, LOQ=0,01µg/mL.
Căn cứ vào kết quả thu được đề tàinhận thấy trong quy trình phân tích MA trong mẫu nước có giới hạn phát hiện 0,001µg/mL, giới hạn định lượng là 0,01µg/mL. Vậy khoảng tuyến tính của MAtrong quy trình phân tích MAniệu là (LOQNước tiểu– 5)µg/mL tương đương (0,01-5)µg/mL.
c) Đánh giá độ chính xác của phương pháp
Theo quan điểm của tiêu chuẩn quốc tế (ISO – 15189) và tiêu chuẩn Quốc gia (TCVN 6910 1- 6:2005) độ chính xác của phương pháp được đánh giá qua độ chụm và độ đúng [4], [5].
- Độ chụm chỉ mức độ giao động của các kết quả thử nghiệm độc lập quanh giá trị trung bình.
- Độ đúng chỉ mức độ gần nhau giữa giá trị trung bình của kết quả thử nghiệm và giá trị thực hoặc giá trị được chấp nhận là đúng.
* Kiểm tra độ chụm
Trong khuôn khổ đề tài đề tài kiểm tra độ chụm bằng cách dùng mẫu thử thêm chuẩn – pha ba loại mẫu có nồng độ thêm chuẩn bằng giá trị gần điểm đầu, điểm giữa, điểm gần cuối của khoảng tuyến tính (tương đương với các mức nồng độ thấp, trung bình, cao). Mỗi mức nồng độ lặp lại 10 lần. Trên cơ sở kết quả các mẫu lặp lại đề tàiđánh giá độ thu hồi theo công thức sau:
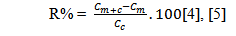
Trong đó: R%: Độ thu hồi
Cm+c: Nồng độ chất phân tích trong mẫu thêm chuẩn
Cm: Nồng độ chất phân tích trong mẫu thử
Cc: Nồng độ chuẩn thêm (lý thuyết)
Sau đó tính độ thu hồi chung là trung bình của độ thu hồi các lần lặp lại
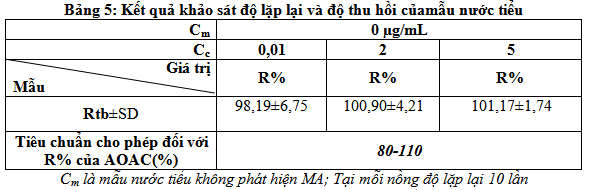
Theo tiêu chuẩn của AOAC với khoảng nồng độ từ 0,01-10µg/mL hiệu suất thu hồi cho phép là từ 80-110%. Kết quả ở bảng 5 cho thấy hiệu suất thu hồi của quy trình phân tích nằm trong tiêu chuẩn cho phép. Điều đó chứng tỏ độ chụm của phương pháp đạt yêu cầu.
* Kiểm tra độ đúng
Có nhiều cách để đánh giá độ đúng của phương pháp. Trong nghiên cứu này chúng tôi đã sử dụng mẫu chuẩn để đánh giá độ đúng của quy trình phân tích. Mẫu chuẩn hay còn gọi là vật liệu chuẩn – là mẫu phân tích có hàm lượng đã được xác định trước và đúng. Có nhiều cấp vật liệu chuẩn khác nhau, trong đó cao nhất là CRM (Certified reference materials – mẫu chuẩn được chứng nhận) được cung cấp bởi các tổ chức có uy tín trên thế giới (RECIPE – của Đức). Kết quả phân tích mẫu CRM thể hiện qua bảng sau:
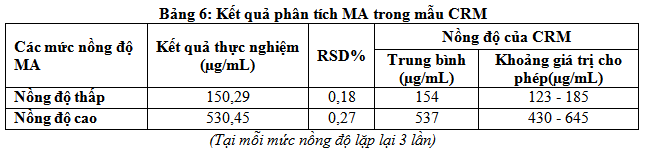
Từ Bảng 6 đề tài nhận thấy kết quả phân tích mẫu CRM cho các giá trị nằm trong khoảng giá trị đã cho và sát với giá trị trung bình của mẫu CRM. Ở mức nồng độ thấp 150,29(µg/mL) xấp xỉ giá trị trung bình của mẫu CRM (154 µg/mL) và thuộc khoảng giá trị đã cho là (123-185µg/mL). Tương tự, ở mức nồng độ cao các giá trị thu được đều nằm trong khoảng cho phép. Giá trị trung bình thu được là 530,4 xấp xỉ giá trị trung bình của mẫu CRM (537µg/mL) và thuộc khoảng giá trị đã cho là (430 – 645µg/mL). Điều đó chứng tỏ phương pháp phân tích đảm bảo độ đúng.
Từ kết quả kiểm tra độ chụm và độ đúng của phương pháp cho thấy phương pháp mà đề tàikhảo sát đảm bảo độ chính xác.
d) Đánh giá độ ổn định của phương pháp
Có nhiều cách để đánh giá độ ổn định của phương pháp: có thể sử dụng mẫu CRM, khi không có mẫu CRM thì có thể sử dụng (chuẩn F) hoặc (chuẩn t) để đánh giá hai nhóm kết quả trong 2 điều kiện[4],[5]. Trong nghiên cứu này để kiểm tra độ ổn định của phương pháp đề tài tiến hành với mẫu CRM khi thay đổi điều kiện về thời gian phân tích kết quả thu được như sau:
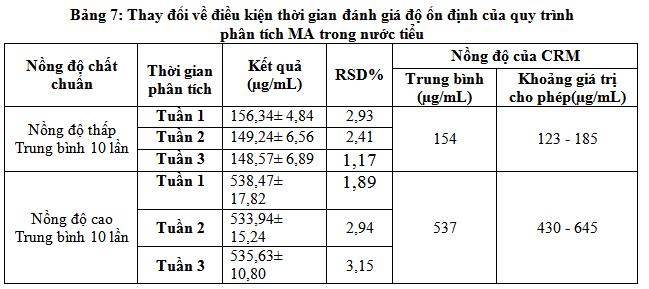
Với điều kiện thay đổi về thời gian khác nhau, các lần phân tích cách nhau 1 tuần độ ổn định của phương pháp vẫn đảm bảo. Đề tàiđưa ra nhận định này vì kết quả đánh giá ở bảng 7 cho thấy: với các thời điểm phân tích khác nhau kết quả mẫu CRM thu đượcđều nằm trong khoảng giới hạn cho phép và ở các mức nồng độ giá trị thu được luôn gần với giá trị trung bình cho trước của mẫu CRM.
Như vậy, qua việc đánh giá những tiêu chí cần thiết cho một quy trình phân tích,đề tài nhận thấy quy trình phân tích MA trong nước tiểu bằng phương pháp sắc ký lỏng khối phổ của đề tàilà đạt yêu cầu của một quy trình phân tích.
Từ quy trình trên đề tàicó một số nhận xét như sau:
So với kết quả nghiên cứu của một số tác giả cho thấy quy trình của đề tàicó khoảng tuyến tính, giới hạn phát hiện và giới hạn định lượng tương đương, thậm chí còn tốt hơn một số quy trình phân tích của một số tác giả khác. Cụ thể so với phương phápcủa S.C.Chua và cộng sự[6], C.W.Lee và cộng sự[7] phân tích trên máy sắc ký lỏng hiệu năng cao cóLODMA = 0,5µg/mlthì LOD của đề tàitốt hơn nhiều (0,001µg/ml).Nghiên cứu của S.W. Cui và cộng sự[8]phân tích trên máy GC/MS có LOD = 5,4 mg/L, LOQ là 17,9 mg/L – cao hơn nhiều so với LOD, LOQ của đề tài. So với phương pháp của CDC mà đề tài đã tham khảo[3] – quy trình phân tích cũng trên thiết bị sắc ký lỏng khối phổLC/MS/MS, LOD của phương pháp này là 0,012µg/ml – cao hơn so với LOD của đề tàixây dựng được. Phương pháp của CDC có khoảng tuyến tính 0,012- 0,408µg/ml, hẹp hơn so với khoảng tuyến mà đề tàithu được (0,01-5µg/ml), và hiệu suất thu hồi (98,19 – 101,17%), độ chính xác trên 97% tương đương với phương pháp của CDC và tốt hơn của S.C.Chua và cộng sự[6] – có hiệu suất thu hồi là 96%, cũng như phương pháp của C.W.Lee và cộng sự[7] có hiệu suất thu hồi là 95%.Ngoài ra so với phương pháp của CDC mà đề tàiđã tham khảo thì phương pháp phân tích của chúng tôi sử dụng pha động với một kênh có Ammonium acetate (10mM), tiết kiệm hơn so với phương pháp của CDC là Ammonium acetate (15mM). Từ những điều nhận định ở trên cho thấy quy trình phân tích của đề tàicó độ chính xác, độ nhạy tốt hơn một số quy trình đã phân tích trên các thiết bị như sắc ký lỏng hiệu năng cao đã được công bố, thậm trí trên tốt hơn quy trình phân tích hơn trên máy sắc ký khí khối phổ của S.W.Cui và cộng sự[8], tương đương với quy trình của CDC phân tích trên.
3.2. Kết quả xác định chất chuyển hóa
Để ứng dụng quy trình phân tích xác định chất chuyển hóa MA của ethylbenzen trong nước tiểu, đề tàilấy 90 mẫu nước tiểu của công nhân tiếp xúc với dung môi hữu ở ngành sản xuất sơn kết quả thu được như sau:

Kết quả bảng 8 cho thấy: Trong 90 đối tượng tiếp xúc trực tiếp với ethylbenzen được lấy nước tiểu xét nghiệm nồng độ MA, thì nồng độ trung bình của MA thu được là 87,87±86,93 (mg/gre). Theo nghiên cứu của Knecht U và cộng sự cho thấy tại nồng độ ethylbenzen tối đa cho phép MA thu được là xấp xỉ 144mg/gcre. Như vậy kết quả trung bình của MA ở số đối tượng có tiếp xúc trực tiếp với ethylbenzen có giá trị thấp hơn giá trị ước tính của MA tại nồng độ ethylbenzen tối đa cho phép.
Tuy nhiên, nếu xét trên từng đối tượng thì kết quả cho thấy có 11 đối tượng (12,22%) có nồng độ MA ≥ 144mg/gcre. Điều này cho thấy có nhiều người lao động đã tiếp xúc với ethylbenzen vượt tiêu chuẩn cho phép. Theo ACGIH(2018) của Mỹ và nhiều nước trên thế giới – đang sử dụng hai sản phẩm chuyển hóa của ethylbenzen trong nước tiểu làm chỉ số giám sát sinh học đó là chỉ số axit mandelic (MA) và axit phenylglyoxylic (PGA) với giá trị cho phép là ≤150mg/gcre[1]. Tức là nếu phân tích đầy đủ cả 2 chỉ số MA và PGA thì tỷ lệ người lao động có nồng độ PGA + MA cao hơn tiêu chuẩn cho phép sẽ cao hơn 11,22% (đây là tỷ cao cao hơn tiêu chuẩn cho phép theo ước tính của tác giảKnecht U trong trường hợp chỉ sử dụng MA làm chỉ số giám sát sinh học)[9]
Từ kết quả nghiên cứu này cho thấy cần thiết áp dụng cả 2 chỉ số MA và PGA để làm chỉ số giám sát sinh học cho người lao động có tiếp xúc với ethylebenzen. Ngoài việc nghiên cứu phương pháp phân tích MA trong nước tiểu thì phải nghiên cứu phương pháp phân tích PGA trong nước tiểu. Có như vậy mới bảo vệ được người lao động có tiếp xúc với ethylbenzen một cách an toàn và hiệu quả, phòng tránh được bệnh nghề nghiệp do chất này gây nên.
Sau khi sử dụng quy trình xây dựng được để phân tích mẫu thực, đề tàinhận thấy quy trình ổn định, đảm bảo kết quả chính xác. Chính vì vậy quy trình dự thảo ban đầu không cần thay đổi gì sau khi đề tàiáp dụng thực tế. Quy trình này có thể ứng dụng trên các máy thế hệ tương đương hoặc thế hệ tiếp theo của hãng. Đối với những hãng khác nếu là những máy có điều kiện và tính năng kỹ thuật tương tự, hiện đại hơn thì càng tốt đều có thể dùng được.
IV. KẾT LUẬN VÀ KIẾN NGHỊ
4.1. Kết Luận
* Xây dựng được quy trình kỹ thuật phân tích định lượng chỉ số axit mandelic(MA)với những thông số cơ bản là: Khoảng tuyến tính: 0,01-5µg/ml; Giới hạn phát hiện: 0,001µg/mL; Giới hạn định lượng: 0,01µg/mL. Quy trình đảm bảo tính ổn định, độ chính xác trên 95%. Giới hạn phát hiện (LOD) và giới hạn định lượng (LOQ)tương đương và thấp hơn một số tác giả khác đã nghiên cứu; tiết kiệm được hóa chất và thời gian phân tích.
* Áp dụng quy trình xây dựng được đãphân tích 90 mẫu nước tiểu của 90 đối tượng tiếp xúc với ethylbenzen cho thấy có 12,22% đối tượng có nồng độ MA niệu vượt quá nồng độ tương ứng quá giới hạn cho phép của ethylbenzen trong môi trường.
4.2. Kiến nghị
Cần áp dụng rộng rãi kỹ thuật xác định MA trong nước tiểu, kết hợp với kỹ thuật phân tích PGA trong nước tiểu để làm công cụ giám sát sinh học cho người lao động có tiếp xúc vớiethylbenzen.
TÀI LIỆU THAM KHẢO
[1] American Conference of Industrial Hygienists, Threshold Limit Value for Chemical Substances and Physical Agents and Biological Exposure Indices. 2018, p. 112
[2] American Conference of Governmental Industrial Hygienists. (2014), “Etylbenzen. In: Documentation of the Threshold Limit Vales and Biological Exposure Indices, 7th edition. ACGIH, Cincinnati OH”.
[3] The Centers for Disease Control and Prevention. (2012), “Laboratory Procedure Manual”. National Center for Environmental Health
[4] Tạ Thị Thảo, Thống kê trong hóa phân tích. Giáo trình môn học,Trường Đại học Khoa học Tự nhiên Đại học Quốc Gia Hà Nôi, 2010
[5] Viện kiểm nghiện an toàn vệ sinh Thực phẩm Quốc Gia, Thẩm định phương pháp trong phân tích hóa học và vi sinh vật học. NXB Khoa học và Kỹ Thuật, 2010
[6] S. C. Chua, B. L. Lee, L. S. Liau et al. (1993), “Determination of mandelic acid and phenylglyoxylic acid in the urine and its use in monitoring of styrene exposure”, J Anal Toxicol, vol. 17, no. 3, pp. 129-32.
[7] Cheol-Woo Lee and et al. (2009), “Rapid HPLC Method for the Simultaneous Determination of Eight Urinary Metabolites of Toluene, Xylen and Styren”, Korean Chem, vol. 30, no. 9, pp. 2021- 2026
[8] SW Cui, XF Pan, and HF Yan. (2017), “Determination of phenylglyoxylic acid and mandelic acid in urine by high performance liquid chromatography method”, Zhonghua lao dong wei sheng zhi ye bing za zhi= Zhonghua laodong weisheng zhiyebing zazhi= Chinese journal of industrial hygiene and occupational diseases, vol. 35, no. 10, pp. 774-776.
[9] Udo Knecht, Antje Reske, and Hans-Joachim Woitowitz. (2000), “Biological monitoring of standardized exposure to ethylbenzene: evaluation of a biological tolerance (BAT) value”, Archives of toxicology, vol. 73, no. 12, pp. 632-640.
Nguyễn Thị Hiền, Tống Thị Ngân, Nguyễn Thị Điềm, Đỗ Thị Cẩm Nhung, Vũ Xuân Trung
Viện KH An toàn và vệ sinh lao động
(Nguồn tin: Vnniosh.vn)
