Xây dựng quy trình phân tích Crom tổng trong nước tiểu bằng phương pháp quang phổ hấp thụ nguyên tử
1. ĐẶT VẤN ĐỀ
Hiện nay, Cr ngày càng được sử dụng phổ biến trong nhiều ngành công nghiệp như: luyện kim, khai thác mỏ, tạo màu thuốc nhuộm, sơn, mạ điện, mạ Cr nhờ tính chất chống ăn mòn tốt, có độ cứng cao và tạo màu đẹp.Cùng với tác dụng to lớn của Cr trong các ngành công nghiệp, thì vấn đề ô nhiễm môi trường có nguyên nhân do Cr gây ảnh hưởng rất lớn đến sức khỏe con người và các loài động thực vật. Đặc biệt nhiễm độc Cr từ nguồn gốc nghề nghiệp dẫn đến tác hại lâu dài tới sức khỏe người lao động.
Cr xâm nhập vào cơ thể qua thực phẩm, quahô hấp, qua da và bài tiết chủ yếu qua nước tiểu. Trên thế giới đã có nhiều nghiên cứu về ảnh hưởng nghiêm trọng của Cr đến người lao động làm việc trong các ngành nghề tiếp xúc trực tiếp với Cr như tình trạng viêm da nghề nghiệp, thủng vách ngăn mũi (Lindberg và Hedenstierna 1983; Dayan và Paine 2001), các tổn thương đường hô hấp, tiêu hóa và tiết niệu ở nhiều mức độ. Cơ quan Nghiên cứu Quốc tế về Ung thư ( IARC ) đã phân loại Cr (VI) là một chất gây ung thư. Nhiều nước trên thế giới công nhận Cr là tác nhân gây nên bệnh nghề nghiệp được bảo hiểm. Việc xây dựng quy trình phân tích Cr trong dịch sinh học đã được nhiều nhà khoa học trên thế giới tiến hành và có nhiều phương pháp được công bố như: Phương pháp phổ hấp thụ nguyên tử (AAS), phương pháp quang phổ hấp thụ phân tử UV-VIS, phương pháp phổ khối lượng plasma cao tần cảm ứng ICP-MS, phương pháp phổ phát xạ nguyên tử ICP-OES, phương pháp phổ huỳnh quang tia X….. đặc biệt phương pháp phổ hấp thụ nguyên tử sử dụng kĩ thuật lò Graphite được sử dụng rộng rãi do sử dụng ít mẫu, cho giới hạn phát hiện thấp, chi phí hợp lý.
Ở Việt Nam nhiễm độc Cr đã được công nhận là bệnh nghề nghiệp và đã có một số nghiên cứu về ảnh hưởng của kim loại này đến người lao động ở một số ngành nghề. Tuy nhiên việc xây dựng quy trình phân tích Cr trong dịch sinh học ở Việt Nam trên những thiết bị công nghệ hiện đại gần như chưa được quan tâm. Do đó chúng tôi lựa chọn nghiên cứu đề tài “Nghiên cứu xây dựng quy trình xác định nồng độ Cr tổng trong nước tiểu bằng phương pháp quang phổ hấp thụ nguyên tử ” với hi vọng xây dựng một quy trình chuẩn, xác định nồng độ Cr trong nước tiểu. Trên cơ sở đó, xác định được mức độ thấm nhiễm Cr ở người lao động trong các ngành nghề sản xuất có nguyên tố này, từ đó có những biện pháp bảo vệ người lao động một cách kịp thời và có hệ thống.
- Mục tiêu của đề tài:
Xây dựng được quy trình phân tích nồng độ Cr tổng trong nước tiểu bằng quang phổ hấp thụ nguyên tử kỹ thuật không ngọn lửa. Giới hạn phát hiện của quy trình là 0,5µg/ l, độ chính xác trên 85%.
2. ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Đối tượng nghiên cứu
Quy trình phân tích Cr trong nước tiểu của 35 công nhân khỏe mạnh làm việc trong môi trường tiếp xúc với mạ Cr (VI). Độ tuổi: 25-55 tuổi
2.2.Phương pháp nghiên cứu
2.2.1. Thiết kế nghiên cứu
Thử nghiệm trong phòng thí nghiệm kết hợp với nghiên cứu cắt ngang.
2.2.2. Phương pháp nghiên cứu
Thử nghiệm ứng dụng phương pháp phân tích Quang phổ hấp thụ nguyên tử GF-AAS
Chuẩn bị dung dịch
– Dung dịch modiffier (dung dịch cải biến nền):
Mg(NO3)2 1 g/l +Pd(NO3)2 0,5g/l
– Dung dịch rửa: 0.1% Triton X-100, 0.2%HNO3(70%)
– Dung dịch pha loãng mẫu: HNO3 0,2% + Triton X -100 0,1%
– Pha dung dịch chuẩn (pha trong HNO3 0.2 %): Dung dịch Cr có nồng độ 15µg/L
– Xử lý mẫu:Mẫu được lấy ra từ tủ âm sâu giã đông bằng cách để trong ngăn mát tủ lạnh thường sau khi giã đông đưa ra ngoài để để phân tích. Trước khi phân tích phải lắc đều. Lấy 0.9 ml dung dịch pha loãng + 0.3 ml mẫu nước tiểu lắc đều rồi đưa vào máy phân tích. Mẫu phải được đưa vào phân tích ngay, không được để quá 1 tiếng tính từ thời điểm trộn xử lý mẫu xong.
3. KẾT QUẢ VÀ BÀN LUẬN
3.1. Chuẩn hóa các điều kiện cho phép đo phổ hấp thụ nguyên tử cho nguyên tố Cr
Việc nghiên cứu chọn các thông số đo phù hợp với phép phân tích định lượng một nguyên tố hóa học là một công việc rất cần thiết và quan trọng trong kỹ thuật AAS nói chung và kỹ thuật không ngọn lửa nói riêng (GF-AAS). Sử dụng những dung dịch đã chuẩn bị trong phần phương pháp chúng tôi tiến hành khảo sát các thông số của máy thu được kết quả như sau:
Khi khảo sát vạch phổ của nguyên tố Cr (với 3 vạch phổ : 357,9; 359,4; 360,3 nm), độ rộng khe đo trên máy (0.2nm, 0.7nm và 2nm), cường độ đèn (từ 60% đến 87% cường độ đèn tối đa). Nhóm nghiên cứu thu được kết quả là: tại tại vạch phổ λ = 357,9 nm, khe đo 0.7nm và cường độ đèn 20 mA (67% Imax)cho độ hấp thụ tốt nhất và ổn định nhất. Chính vì vậy nhóm nghiên cứu đã chọn các giá trị trong trên là các giá trị cho việc khảo sát các điều kiện tiếp theo.
3.1.1.Kết quả khảo sát các điều kiện nguyển tử hóa mẫu
Quá trình nguyên tử hóa mẫu của kỹ thuật nguyên tử hóa không ngọn lửa xảy ra theo 4 giai đoạn kế tiếp nhau trong thời gian tổng cộng từ 60 – 80 giây. Các giai đoạn đó là: sấy khô mẫu, tro hoá luyện mẫu, nguyên tử hoá, làm sạch cuvet[1].Mỗi giai đoạn đều có vai trò nhất định trong quá trình nguyên tử hóa mẫu và liên quan chặt chẽ với nhau. Để có kết quả phân tích tốt nhóm nghiên cứu tiến hành khảo sát từng giai đoạn để tìm được điều kiện phù hợp nhất cho quá trình nguyên tử hóa mẫu với các giá trị cụ thể như sau:
Giai đoạn sấy mẫu
Giai đoạn sấy mẫu 1: Nhiệt độ sấy mẫu khảo sát trong khoảng từ (900C-1300C). Thời gian tăng nhiệt từ (1-15s). Thời gian giữ nhiệt từ (5-40s).
Giai đoạn sấy mẫu 2: Nhiệt độ sấy mẫu khảo sát trong khoảng từ (160-2400C). Thời gian tăng nhiệt từ (5-25s). Thời gian giữ nhiệt từ (5-40s).
Giai đoạn tro hóa mẫu: Đây là giai đoạn thứ hai của quá trình nguyên tử hóa mẫu. Mục đích của giai đoạn tro hóa luyện mẫu là để tro hóa (đốt cháy) các hợp chất hữu cơ và mùn có trong mẫu sau khi đã sấy khô, đồng thời nung luyện mẫu thành hỗn hợp nóng chảy đồng nhất chuẩn bị cho giai đoạn nguyên tử hóa tiếp theo đạt hiệu suất cao và ổn định. Giai đoạn này có ảnh hưởng rất nhiều đến quá trình phân tích, nếu nhiệt độ tro hóa quá cao dẫn đến một số hợp chất có thể bị phân hủy mất trong giai đoạn này. Theo kinh nghiệm thực tế của phép đo GF-AAS với các chất vô cơ thì nhiệt độ tro hóa từ 400- 18000C, nên tro hóa mẫu ở nhiệt độ thấp hơn nhiệt độ giới hạn từ 30-500C hay cao nhất bằng nhiệt độ giới hạn, thời gian tro hóa là 30 giây, trong đó 10 giây để tăng nhiệt độ từ nhiệt độ sấy đến nhiệt độ tro hóa, 20 giây giữ ở nhiệt độ không đổi để luyện mẫu. Nhiệt độ tro hóa luyện mẫu khảo sát trong khoảng từ (12000C-18000C). Thời gian tăng nhiệt từ (5-25s). Thời gian giữ nhiệt từ (5-30s).
Giai đoạn nguyên tử hóa mẫu: Đây là giai đoạn quan trọng quyết định cường độ vạch phổ. Giai đoạn này được thực hiện trong thời gian ngắn thường từ 3-5 giây, với tốc độ tăng nhiệt rất lớn từ 1500-25000C để đạt ngay tức khắc nhiệt độ nguyên tử hóa và thực hiện phép đo cường độ vạch phổ. Nhiệt độ nguyên tử hóa của mỗi chất là khác nhau phụ thuộc vào bản chất nguyên tố phân tích, dạng muối liên kết hợp chất tồn tại của nó trong mẫu nhất là chất nền của mẫu. Nhiệt độ nguyên tử hóa mẫu khảo sát trong khoảng từ (20000C-25000C). Thời gian nguyên tử hóa là 5 giây
Với các điều kiện khảo sát ở trên kết quả thu được ở bảng dưới đây:
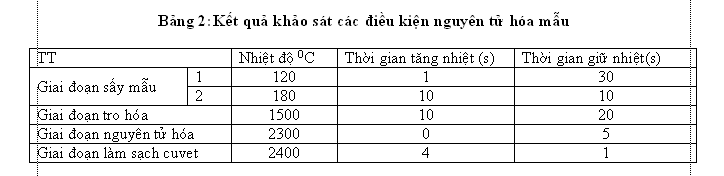
Tức là tại các giá trị trong bảng trên nhóm nghiên cứu nhận thấy độ hấp thụ quang tốt nhất và ổn định nhất. Chính vì vậy nhóm nghiên cứu để chọn các giá trị trong bảng trên làm giá trị ở giai đoạn nguyên tử hóa mẫu cho quy trình phân tích Cr trong nước tiểu.
3.1.2. Khảo sát các yếu tố ảnh hưởng đến phép đo phổ hấp thụ không ngọn lửa
Nhóm nghiên cứu xác định một số yếu tố ảnh hưởng chính là: loại axit, nồng độ axit, thành phần và nồng độ chất cải biến nền (modifier). Kết quả khảo sát cụ thể được trình bày dưới đây:
3.1.2.1. Khảo sát ảnh hưởng nồng độ axit HNO3
Theo kết quả nghiên cứu của Phạm Luận[1] trong phân tích kim loại nặng bằng máy quang phổ hấp thụ nguyên tử không ngọn lửa thì axit HNO3 được xem là axit phù hợp nhất cho kết quả tốt nhất. Chính vì vậy nhóm nghiên cứu chọn axit HNO3 là axit dùng để phân tích Cr trong mẫu nước tiểu.
Tuy nhiên, nồng độ axit ảnh hưởng rất lớn đến kết quả của phép đo, thậm chí nồng độ axit HNO3 cao hơn 5% sẽ ảnh hưởng đến độ bền của lò. Nồng độ axit khác nhau tạo nên độ nhớt của dung dịch khác nhau và kết quả phân tích cũng khác nhau. Để đảm bảo kết quả phân tích nhóm nghiên cứu tiến hành phân tích ảnh hưởng của nồng độ axit HNO3 ở các mức sau: 0.1%, 0.2%, 0.3%, 0.4% , 0.5% kết quả cho thấy sự khác nhau về nồng độ axit dẫn đến sự khác nhau về độ hấp thụ quang.Tuy không nhiều nhưng nhóm nghiên cứu nhận thấy với nồng độ HNO3 = 0.2% cho cường độ vạch phổ và độ ổn định là tốt nhất.
3.1.2.2. Khảo sát chọn chất cải biến nền
Thành phần của nền mẫu trong nước tiểu có ảnh hưởng lớn tới độ nhạy của phép đo. Vì vậy để kết quả phân tích có độ chính xác cao ta phải tìm cách làm giảm hoặc loại trừ ảnh hưởng của nền mẫu. Để làm được điều này có thể tăng nhiệt độ nguyên tử hóa hoặc hoặc thêm vào mẫu phân tích chất cải biến hóa học để làm thay đổi chất nền của mẫu. Trong đó việc thêm vào mẫu phân tích chất cải biến hóa học được ứng dụng rộng rãi cho nhiều đối tượng khác nhau. Nhóm nghiên cứu khảo sát các chất cải biến nền có thành phần như sau: (NH4)2HPO41g/L, NH4H2PO41g/L; Pd(NO3)2 0,5g/L; Mg (NO3)21g/L; 0,5 g/l Pd(NO3)2 và Mg (NO3)2 1g/L; Mg (NO3)21g/L+ NH4H2PO41g/L
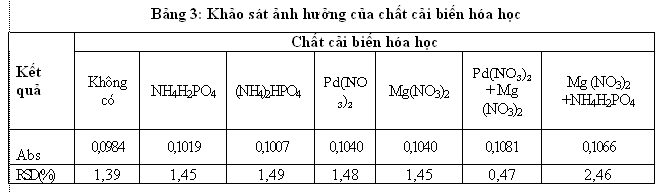
Qua kết quả khảo sát cho thấy khi có mặt chất cải biền hóa học độ hấp thụ quang tăng ổn định hơn khi không có chất cải biến hóa học. Trong đó modifer là 0,5 g/l Pd và 1 g/l Mg (NO3)2 cho độ hấp thụ quang cao và ổn định nhất
3.1.3. Khảo sát ảnh hưởng thể tích chất bổ trợ – cải biến nền(modifier)
Sau khi chọn được chất cải biến nền thích hợp là 0,5g/l Pd và 1 g/l Mg (NO3)2 ta khảo sát thể tích của chất cải biến nền lần lượt là 5, 10, 15, 20, 25 µl
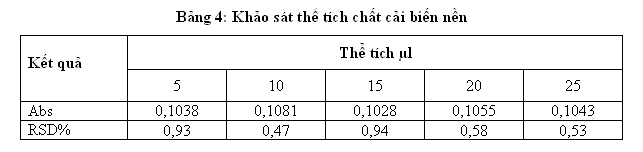
Qua khảo sát thể tích chất cải biến nền cho thấy thể tích chất cải biến nền là 10 µl cho độ hấp thụ quang cao và ổn định nhất. Thể tích chất bổ trợ càng tăng thì độ hấp thụ càng giảm. Điều đó cho thấy chất bổ trợ có vai trò rất quan trong trong việc cải biến nền và tăng độ hấp thụ quang đối với mỗi nguyên tố.Tuy nhiên, chỉ ở nồng độ nhất định nếu dùng với nồng độ cao sẽ gây tác dụng ngược lại.
3.2. Chọn các điều kiện lấy mẫu, xử lý mẫu để có dung dịch đo
3.2.1. Lấy mẫu
Lấy 10-12ml Mẫu nước tiểu lấy ở đối tượng nghiên cứu, bảo quản lạnh trước khi mang về phòng thí nghiệm.
Ở điều kiện âm sâu -800C đến -200C mẫu có thể bảo quản được 6-8 tháng.
3.2.2. Xử lý mẫu
Hiện nay các quy trình xử lý mẫu để xác định kim loại trong mẫu sinh học như nước tiểu, máu, huyết thanh thường được xử lý trực tiếp bằng cách pha loãng mẫu với một dung dịch thích hợp mà phổ biến là pha loãng với dung dịch HNO3 hoặc dung dịch HNO3 0,2% + Triton X -100 0,1%. Phương pháp này có ưu điểm là tốn ít thời gian, phương pháp chuẩn bị mẫu đơn giản, tốn ít hóa chất hơn rất nhiều so với phương pháp vô cơ hóa ướt và phương pháp xử lý mẫu trong lò vi sóng. Do vậy trong đề tài này chúng tôi khảo sát kỹ thuật xử lý mẫu bằng cách pha loãng mẫu CRM (nồng độ 19,9µg/l ) 4 lần với 2 dung dịch này:
Kết quả được chỉ ra trong bảng:
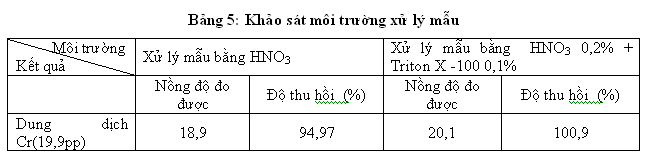
Sau khi khảo sát được môi trường xử lý mẫu thích hợp chúng tôi khảo sát tỷ lệ pha loãng mẫu CRM (nồng độ 19,9µg/l ) với dung dịch HNO3 0,2% + Triton X -100 0,1%. : Qua khảo sát ta thấy khi pha loãng mẫu từ 2-4 lần cho kết quả tốt nhất. Vì tỷ lệ này cho kết quả gần với trị trung bình của mẫu. Khi không pha loãng mẫu thì các thành phần trong mẫu ảnh hưởng tới độ hấp thụ quang của mẫu làm tín hiệu đo giảm, ngược lại khi pha loãng mẫu nhiều lần thì dẫn đến sai số lớn khi nhân với hệ số pha loãng. Chính vì vậy đòi hỏi các nhà phân tích phải khảo sát kỹ nồng độ tỷ lệ của các chất khi sử dụng mới có thể đưa ra được phương pháp phân tích đạt hiệu quả cao.
3.3. Đánh giá các điều kiện của quy trình
3.3.1. Khảo sát khoảng tuyến tính và xây dựng đường chuẩn của phép đo GF-AAS đối với Cr.
3.3.1.1. Khảo sát khoảng tuyến tính
Nhóm nghiên cứu tiến hành khảo sát khoảng tuyến tính của Cr bằng cách: pha một dãy chuẩn của Cr trong HNO3 nồng độ 0.2% từ 0,5-140 µg/l. thu được kết quả như sau :
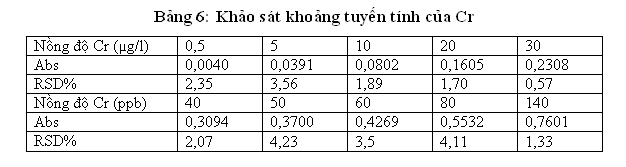
Từ kết quả thực nghiệm nhóm nghiên cứu nhận thấy khoảng tuyến tính của Cr từ LOQ-50ppb. Vì vậy khi phân tích mẫu nếu hàm lượng nguyên tố cần phân tích nằm ngoài khoảng tuyến thì phải làm giàu mẫu hoặc pha loãng mẫu để phân tích mới đảm bảo được độ chính xác của phép đo.
3.3.1.2. Xây dựng đường chuẩn
3.3.1.2.1. Đường chuẩn
Từ kết quả khảo sát khoảng tuyến tính nhóm nghiên cứu sử dụng phần mềm Origin 8.0 để xây dựng đường chuẩn ta được kết quả như hình. Phương trình đường chuẩn của Cr trong trong nước tiểu được chỉ ra ở dưới đây:
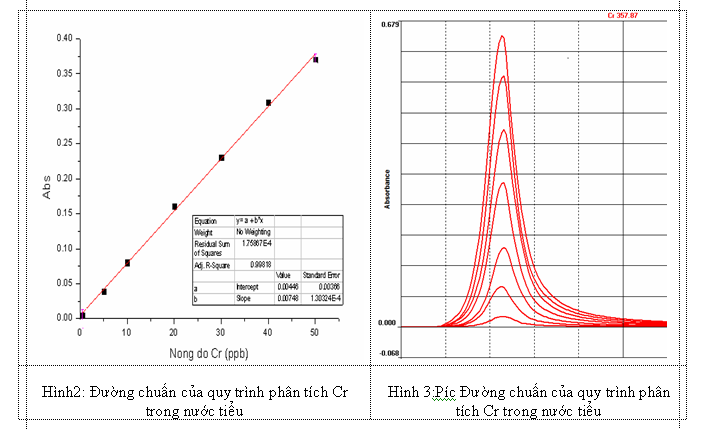
Phương trình hồi quy đầy đủ của đường chuẩn cho phân tích Cr trong nước tiểuđược xác định có dạng: y = y = ( 0,00446 ± 0,00108) + (0,00748 ± 0,00004) x.
3.3.2. Giới hạn phát hiện (LOD), giới hạn định lượng (LOQ)
Để tính được Sb nhóm nghiên cứu tiến hành đo mẫu thử 10 lần. Kết quả thu được như sau:

Từ bảng trên cho thấy giới hạn phát hiện của Crtrong nước tiểulà 0,127ppb.Giới hạn định lượng của Crtrong nước tiểulà 0,423 ppb.
Như vậy khoảng tuyến tính của Cr trong quy trình phân tích Crtrong nước tiểu 0,423 -50 µg/L.
3.3.3.Đánh giá độ chính xác của phương pháp
3.3.3.1.Kiểm tra độ chụm
Độ chụm thay đổi theo nồng độ các chất phân tích. Nồng độ chất phân tích càng thấp thì kết quả dao động càng nhiều (không chụm) nghĩa là RSD% hay CV% lớn.
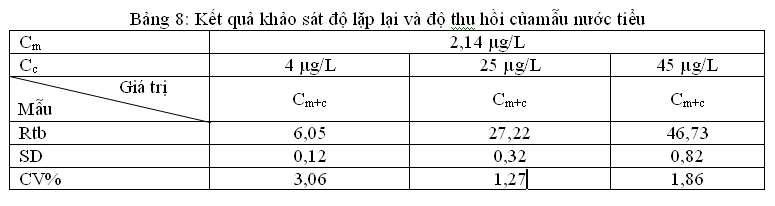
Kết quả khảo sát cho thấy CV%biến động tuân theo định luật phân bố Gauuss: Ở điểm đầu (nồng độ thấp) và điểm cuối (nồng độ cao) của khoảng tuyến tính có hệ số biến thiên lớn hơn điểm giữa (nồng độ trung bình) của khoảng tuyến tính sai số nhỏ hơn. Với mẫu nước tiểu thêm chuẩn điểm đầu sai số 3,06 %, điểm cuối sai số 1,86 %, điểm giữa sai số nhỏ nhất 1,27 %.Theo tiêu chuẩn đánh giá của AOAC nồng độ chất phân tích từ 10-100ppb CV% cho phép là< 15%[3]. Nên những sai số ở trên cả điểm đầu, điểm cuối hay điểm giữa đều là những sai số nhỏ và chấp nhận được. Điều đó chứng tỏ độ chụm của phương pháp đạt yêu cầu.
3.3.3.2.Kiểm tra độ đúng
Có nhiều cách để đánh giá độ đúng của phương pháp. Nhóm nghiên cứu đã chọn cách mà hiện nay được sử dụng phổ biến nhất trên thế giới là dùng vật liệu chuẩn (còn gọi là mẫu chuẩn). Kết quả phân tích mẫu CRM thể hiện qua bảng sau:
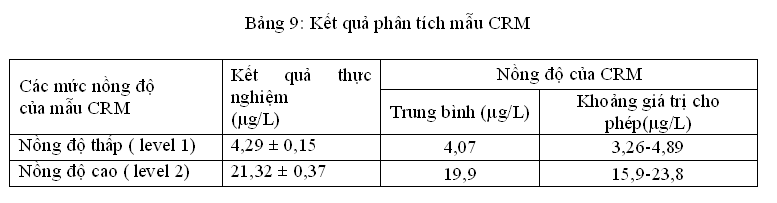
(Lặp lại 3 lần)
Từ bảngtrên nhóm nghiên cứu nhận thấy kết quả phân tích mẫu CRM cho các giá trị nằm trong khoảng giá trị đã cho và sát với giá trị trung bình của mẫu CRM.Điều đó chứng tỏ phương pháp phân tích đảm bảo độ đúng.
3.4. Nêu quy trình xây dựng và ứng dụng
3.4.1. Tổng hợp kết quả các điều kiện đo Crtrong nước tiểu bằng GF-AAS
Qua các kết quả thực nghiệm nhóm nghiên cứu đã chọn được các điều kiện tối ưu để đo Cr trong nước tiểu bằng máy quang phổ hấp thụ nguyên tử GF-AAS của hãng Perkin Elmer 900 như dưới đây:
3.4.1.1. Các điều kiện đo phổ(Thông số và điều kiện)
– Thông số trên máy: vạch phổ 357,9 nm; khe đo 0.7nm và cường độ đèn 20(mA)
– Axit HNO3 0.2%;
– Chất cải biến nền: Mg(NO3)2 1 g/l +Pd(NO3)2 0,5g/l
– Thể tích mẫu: 10µl; Thể tích modifier: 10µl
3.4.1.2.Tổng hợp điều kiện nguyển tử hóa mẫu
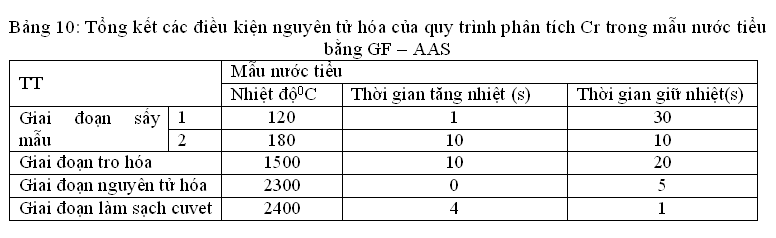
(Lặp lại 3 lần)
– Pha dung dịch chuẩn: Chuẩn được pha trong HNO3 0.2%nồng độCr15µg/L.
– Xử lý mẫu: Mẫu nước tiểu được lấy ra từ tủ âm sâu giã đông bằng cách để trong ngăn mát tủ lạnh qua đêm sau khi giã đông đưa ra ngoài để để phân tích. Trước khi phân tích phải lắc đều. Hút chính xác 0,3 ml nước tiểu vào ống thủy tinh sạch 15 ml. Thêm chính xác 0,9 ml dung dịch pha loãng mẫu: HNO3 0,2% + Triton X -100 0,1% sau đó lắc đều rồi đưa vào máy phân tích.
- Đường chuẩn: + 7 điểm với các mức nồng độ: 0,5ppb; 5ppb; 10 ppb; 20 ppb; 30 ppb, 40 ppb, 50 ppb
Từ quy trình trên nhóm nghiên cứu có một số nhận xét như sau:
Quy trình có giới hạn phát hiện và giới hạn định lượng tương đương thậm chí còn thấp hơn một số quy trình phân tích của một số tác giả khác. Như nghiên cứuInmaculada Aguilera và các cộng sự (2008)[4] giới hạn phát hiện là 0.5µg/L, Mihaela – Flory MARIA [6] giới hạn phát hiện của Cr là 2,47 µg/l; của nhóm nghiên cứu là 0,127 µg/lđối với quy trình phân tích Cr trong mẫu nước tiểu.
So sánh quy trình phân tích Crtrong nước tiểuvới phương pháp của NIOSH (Mỹ) 8005, 8310 thì nhóm nghiên cứu nhận thấy quy trình phân tích được rút ngắn rất nhiều. Nếu như phương pháp 8005, 8310 của NIOSH [8][9] phá mẫu mất nhiều giờ (lắc mẫu ít nhất 12h), thể tích mẫu lớn (50ml nước tiểu), tốn nhiều hóa chất (mỗi mẫu nước tiểu cho 10ml HNO3) thì Quy trình của nhóm nghiên cứu đã khắc phục được những nhược điểm trên.
Hiện nay, ở Việt Nam những quy trình phân tích kim loại trong môi trường, trong thực phẩm thì rất phổ biến. Tuy nhiên, quy trình phân tích kim loại trong dịch sinh học còn nhiều hạn chế. Có thể do thiết bị máy móc cũ. Cũng có trường hợp sử dụng thiết bị hiện đại xong quy trình xử lý mẫu quá phức tạp – theo kiểu truyền thống – vô cơ hóa hoàn toàn bằng axit trên bếp ủ, mất rất nhiều thời gian, sai số lớn. Quy trình mà nhóm nghiên cứu đưa ra khắc phục được những hạn chế trên. Giới hạn phát hiện, giới hạn định lượng tương đương với một số phương pháp hiện tại trên thế giới đang dùng. Quy trình thực hiện đơn giản, sai số ít, đặc biệt xử lý mẫu không còn mất nhiều thời gian như trước.
Quy trình nhóm nghiên cứu xây dựng có thể ứng dựng trên các máy thế hệ tương đương hoặc thế hệ tiếp theo của hãng. Đối với những hãng khác chỉ cần là những máy có điều kiện và tính năng kỹ thuật tương tự (ứng dụng) nếu hiện đại hơn thì càng tốt đều có thể dùng được.
3.4.2. Ứng dụng quy trình
Nhóm nghiên cứu lấy 35 mẫu nước tiểu của NLĐ làm việc tại Công ty Parker có tiếp xúc với mạ Cr áp dụng quy trình xây dựng được phân tích và cho kết quả như sau:

Áp dụng quy trình xây dựng được phân tích mẫu nước tiểu của 35 cán bộ nhân viên làm việc tạiCông ty Parker. Kết quả cho thấy nồng độ Cr trung bình trong mẫu nước tiểu của 35 đối tượng là 3,84 ± 2,78µg/L. Nồng độ trung bình của 35 đối tương đều nằm trong giới hạn cho phép <40 µg/L (Tiêu chuẩn y tế thế giới). Xét riêng từng đối tượng cũng không có đối tượng nào có nồng độ vượt ngưỡng cho phép.
Hoàn thiện quy trình
Sau khi sử dụng quy trình xây dựng được để phân tích mẫu thực, nhóm nghiên cứu nhận thấy quy trình ổn định, đảm bảo kết quả chính xác. Vì trước khi chạy mẫu thực nhóm nghiên cứu đều chạy mẫu chuẩn kiểm tra độ tin cậy của quy trình. Chính vì vậy quy trình dự thảo ban đầu không cần thay đổi gì sau khi nhóm nghiên cứu áp dụng thực tế.
4.KẾT LUẬN VÀ KIẾN NGHỊ
4.1. Kết luận
Qua một thời gian nghiên cứu nhóm thực hiện đã đạt được kết quả cụ thể thể như sau:
– Khoảng tuyến tính: (0,5 -50) µg/L.
– Giới hạn phát hiện: 0.127 µg/L
– Giới hạn định lượng: 0.423 µg/L
– Quy trình đảm bảo tính ổn định, độ chính xác trên 85%.
Đánh giá: LOD, LOQ thấp hơn một số tác giả khác đã nghiên cứu
*Áp dụng quy trình xây dựng được: phân tích 35 mẫu nước tiểu của 35 đối tượng là cán bộ nhân viên làm việc tại Công ty Parkercho thấy nồng Crtrong nước tiểucủa đối tượng nghiên cứu không vượt quá giới hạn cho phép.
4.2. Kiến nghị
Tiếp tục nghiên cứu, hoàn thiện và áp dụng rộng rãi trong các nghiên cứu làm trên đối tượng là người lao động có tiếp xúc với Cr.
TÀI LIỆU THAM KHẢO
1. Phạm Luận (2006), Phương pháp phân tích phổ nguyên tử, NXB Đại học quốc gia Hà Nội.
2. Tạ Thị Thảo (2010), Thống kê trong hóa phân tích, Giáo trình môn học, Trường Đại học Khoa học Tự nhiên Đại học Quốc Gia Hà Nôi.
3. Viện kiểm nghiện an toàn vệ sinh Thực phẩm Quốc Gia (2010), Thẩm định phương pháp trong phân tích hóa học và vi sinh vật học, NXB Khoa học và Kỹ Thuật.
4. Inmaculada Aguileraa, Antonio Dapontea, Fernando Gil. (2008), Biomonitoring of urinary metals in a population living in the vicinity of industrial sources: A comparison with the general population of Andalusia, Spain, 407(1), 669-678
5. International Programme on Chemical Safety (IPCS) (2006). Inorganic chromium (VI) compounds. Draft. Concise International Chemical Assessment Document. WHO. Geneva(18)
6. Mihaela – Flory MARIA*a, Ana – Maria HOSSUb, Petru NEGREAc and Aurel IOVI (2009)GFAAS method for determination of total chromium in urine, Volume 20, pp.80-82
7. Steven T. Sauerhoff, Zoe A. Grosser, and Glen R. Carnrick (1996), The Determination of Chromium and Cadmium in Urine by Graphite Furnace Atomic Absorption, 17,225-228
8. www.cdc.gov/niosh/docs/2003-154/pdfs/8005.pd.
9. www.cdc.gov/niosh/docs/2003-154/pdfs/8310.pdf
10. Xiaonan Dong, Yuzuru NAKAGUCHI and Keizo HIRAKI (1998), “Determination of Chromium, Copper, Iron, Manganese and Lead in Human Hair by Graphite Furnace Atomic Absorption Spectrometry”, vol 14(4), pp 785-789.
11. P. Olmedo, A. Pla, A.F. Hernández, O. López-Guarnido, L. Rodrigo, F. Gil (2010),Validation of a method to quantify chromium, cadmium, manganese, nickel and
CN. Tống Thị Ngân
Viện Nghiên cứu KHKT Bảo hộ lao động
(Nguồn tin: Nilp.vn)
